Содержание
Расход смеси М300 на 1м3 раствора АльфаЦем
Прежде чем приступить к проведению строительно-ремонтных работ, не лишним будет узнать о требуемом расходе материалов, т.е., в нашем случае, какое количество мешков пескобетона нужно для 1м3. Это количество напрямую зависит от маркировки, которая в свою очередь показывает, для каких работ этот материал будет лучшим. Ассортимент пескобетонных сухих смесей представлен различными маркировками (от М100 до М500). Каждая марка имеет различные показатели выдерживаемой полученной застывшей бетонной конструкцией нагрузки на сжатие.
Общие понятия о пескобетоне
Под пескобетоном, как материалом, применяемом на различных этапах строительства, принято понимать сухие смеси, в состав которых обязательно входят первосортный цемент (портландцемент) и различный песок, с зернистостью от 0,8 до 3 мм.
Часто к этим смесям добавляют и другие измельченные компоненты, которые влияют на конечные свойства продукта.
Прочность получаемого застывшего раствора обуславливается соотношением друг к другу главных компонентов сыпучего состава. Цифры, которыми промаркированы мешки (М200, М300, М400), соответствуют способности застывшего раствора выдерживать без каких-либо повреждений определенный вес груза на 1 см2.
Цифры, которыми промаркированы мешки (М200, М300, М400), соответствуют способности застывшего раствора выдерживать без каких-либо повреждений определенный вес груза на 1 см2.
Самым ходовым принято считать пескобетон М300. Его широкое применение объясняется достаточно высокими эксплуатационными свойствами по сравнительно доступной цене.
Преимущества сухой смеси 300 отмечают и профессиональные строители, и мастера-любители, т.к. работа с ней довольно проста, а результат всегда «на высоте».
Применение пескобетона
Готовится строительная смесь из пескобетона по следующим правилам:
- приготовление раствора осуществляется с чистой холодной водой, не превышающей температуры 20°С;
- сухая смесь 300 постепенно добавляется в емкость с жидкостью, постоянно помешиваясь при этом при помощи дрели со специальной насадкой;
- результатом должно стать получение вязкой, пластичной и однородной массы;
- оставить раствор «отдохнуть» в течение 10 минут и затем можно его использовать по прямому применению.

Расчет соотношения воды к сухому веществу проводится по принципу — 1,7 литра жидкости на каждые 10 кг материала. При приблизительном расходе сухой смеси в 1,5 т на 1 м3 понадобится около 255 литров воды (1500*1,7/10). Но это не догма, все зависит от состава, заявленного производителем, и рекомендаций по применению представленных на товарной упаковке, т.к. при переизбытке жидкости прочностные характеристики раствора понизятся.
Расход смеси 300 на 1 м
3
Усредненный показатель расхода обычно указан на упаковке. Однако, как правило, сильно влияет тип проводимых работ при строительстве. Так, выполнение стяжки потребует меньшего количества материала, нежели заливка фундамента.
Расчет выхода пескобетона М300 производится несколькими методами.
Затраты пескобетона при стяжке
Правильный подсчет необходимости материалов потребует знания нескольких параметров, таких как: площадь поверхности, толщина слоя стяжки и усредненный показатель затрат смеси для производства куба рабочего раствора.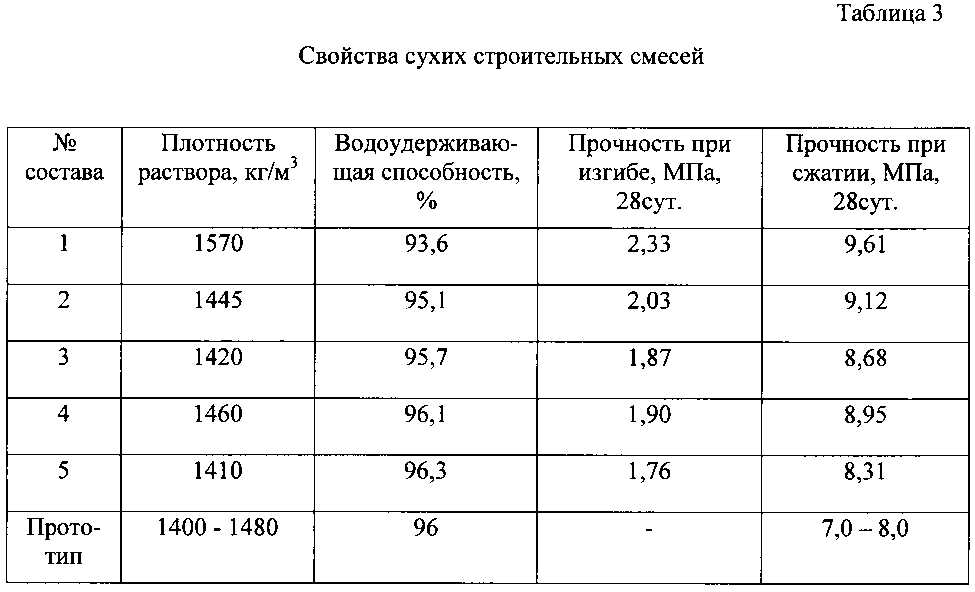 Так, для укладки 1м2 толщиной 10 мм потребуется около 20 кг сухой смеси. Отталкиваясь от этого знания, можно легко подсчитать необходимое количество строительного материала для объекта с любой площадью и нужной толщиной стяжки.
Так, для укладки 1м2 толщиной 10 мм потребуется около 20 кг сухой смеси. Отталкиваясь от этого знания, можно легко подсчитать необходимое количество строительного материала для объекта с любой площадью и нужной толщиной стяжки.
Затраты пескобетона для фундамента
При заливке кубометра фундамента расход сухих смесей составляет приблизительно 1,5-1,7 т. Фасовка материала производится в мешках различного веса (по 20, 25, 40, 50 кг). От этого и нужно отталкиваться. Элементарная математика. 1500 кг делим на вес материала в мешке, например 50 кг, и получаем необходимое количество этих мешков для заливки одного куба, т.е. 30 штук. Дальше это значение умножаем на показатель объема нашего фундамента.
Преимущества покупки в компании «АльфаЦем»
Почти 20 лет безупречной работы компании говорят сами за себя. Огромный ассортимент продукции, обширный личный грузовой автопарк и постоянно заполненные продукцией склады вывели «АльфаЦем» на лидирующие позиции среди отечественных оптовиков стройматериалов.
Обратившись к нам, клиент гарантированно получит:
- продукцию от лучших производителей стройматериалов по лучшим на рынке ценам;
- оперативное обслуживание заказа любого объема в течение всего года;
- квалифицированную консультацию опытного специалиста-строителя перед покупкой;
- своевременную доставку заказа собственным автопарком по Москве и области, а также в любую точку России с помощью железнодорожного транспорта, со складов г. Воскресенска, г. Коломны, г. Жуковского, пос. Селятино.
Группа компаний «АльфаЦем» предлагает только сертифицированную, а значит высококачественную, продукцию от лучших производителей. К тому же действует гибкая система скидок и оплаты.
Вес, объем и пропорции цемента для изготовления строительных растворов
При замешивании цементного раствора неудобно пользоваться рецептурой ГОСТ, где компоненты указаны в долевом соотношении друг к другу. Удобнее использовать привычные меры: мешки или килограммы. Тогда рецепт раствора становится простым и понятным и, смешав все компоненты можно получить материал с заданными техническими характеристиками.
Сколько кг цемента в одном мешке или кубическом метре? Какой объем занимает 1 мешок сухого цемента? Эти вопросы актуальны при расчете стройматериалов, при выборе, т. к. фасовка бывает разной, а ;также при подборе транспорта для доставки. Каждая марка сухого цемента имеет свой вес, а значит и соотношение компонентов при замешивании цементно-песчаного раствора будет разным.
Удельный вес строительного материала по СНиП II-3-79 — это физическая величина, показывающая отношение веса материала к объему, которое он занимает. Сухой цемент занимает значительно меньше места, чем цементный раствор, поэтому из одного килограмма цементного вяжущего получится несколько кг цементно-песчаной смеси.
Удельный вес цемента зависит от многих факторов:
- марки и состава;
- степени помола компонентов;
- способа производства;
- длительности хранения.
Вес свежего цементного порошка (при условии соблюдения температурного и влажностного режима хранения) составляет 1200 кг/м3.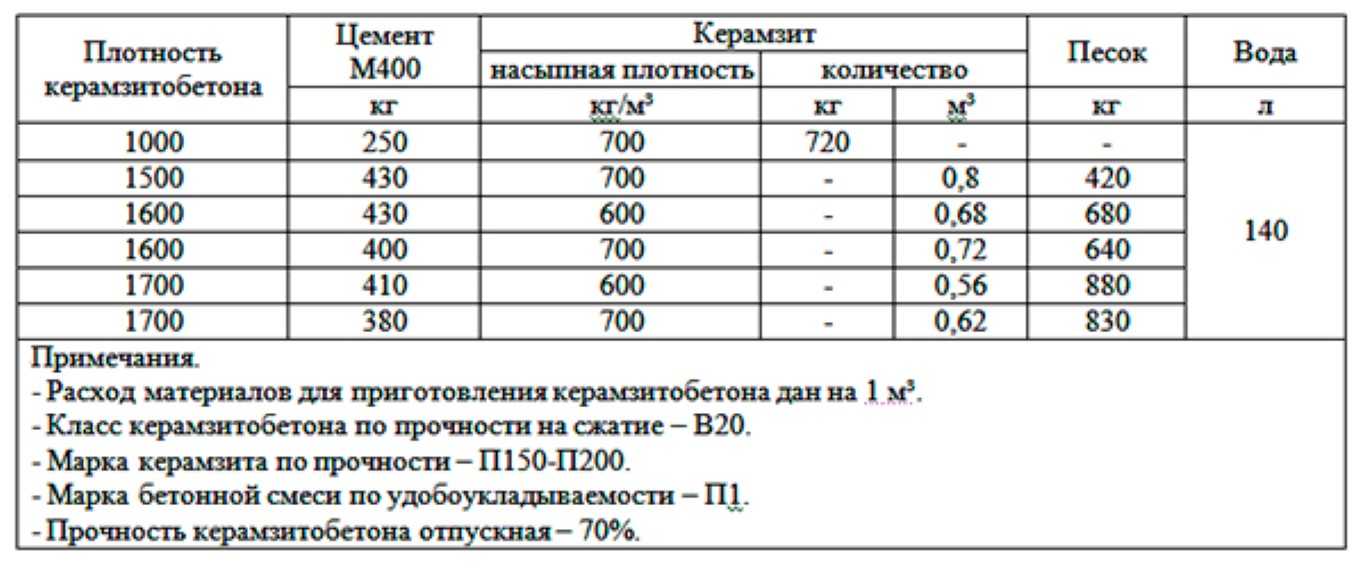 Это минимальный показатель, обусловленный тем, что частицы свежепомолотого материала имеют положительный и отрицательные электрические заряды. За счет разности зарядов частицы отталкиваются друг от друга, плотность порошка уменьшается, а значит, снижаются весовые показатели.
Это минимальный показатель, обусловленный тем, что частицы свежепомолотого материала имеют положительный и отрицательные электрические заряды. За счет разности зарядов частицы отталкиваются друг от друга, плотность порошка уменьшается, а значит, снижаются весовые показатели.
В дальнейшем цементный порошок фасуется, транспортируется, хранится. Электрические заряды исчезают, уходит вовлеченный при производстве воздух и плотность материала повышается. Строители говорят: цемент слёживается. В среднем вес одного кубометра вяжущего через полгода после выпуска при правильном хранении составляет 1550 кг.
При нарушении условий хранения материал может впитывать влагу, что приводит к повышению плотности и соответственно веса. Чем мельче помол порошка, тем больше воды он впитывает и тем больше его масса. Учитывая, что мелкий помол имеют высокие марки цемента, то чем выше марка, тем требовательнее материал к условиям хранения. В зависимости от марки один кубический метр (м3) цемента может давать разницу при взвешивании до 400 кг/м3. Именно поэтому при приготовлении раствора учитывается не только вес, но и марка. Например, для марки М200 соотношение цемент/песок будет 1 к 3, а при использовании марки М400 — 1 к 2,2.
Именно поэтому при приготовлении раствора учитывается не только вес, но и марка. Например, для марки М200 соотношение цемент/песок будет 1 к 3, а при использовании марки М400 — 1 к 2,2.
При грубых расчетах строители используют средний показатель — 1300 кг/м3. Исходя из этого, можно рассчитать, что стандартный мешок на 50 кг содержит примерно 0.04 м3 сухого вяжущего. Параметр имеет решающее значение при заказе транспорта для доставки стройматериалов, т. к. вместимость машины или объем багажника всегда считается в м3 или литрах.
Пропорции цементных растворов
Вес мешка с цементом указан на таре, а вот о плотности производители умалчивают. При этом плотность порошка может изменяться даже в пределах одной марки до 50% в зависимости от условий и продолжительности хранения. Для приготовления цементно-песчаного раствора или бетонной смеси нужно научиться одну величину переводить в другую.
Для замешивания бетона на основе портландцемента М500 пропорция компонентов по ГОСТ 27006-2019 будет такой:
- 1 часть вяжущего;
- 2 части мелкого наполнителя;
- 4 части крупного заполнителя.

Из рецептурного соотношения легко определить объем каждого компонента. Для этого нужно общий объем раствора разделить на количество частей. Например, если нужен 1 м3 смеси, то одна часть — это 1/7 = 0,142 м3. То есть 1 часть любого из компонентов равна этому показателю. Учитывая, что плотность цемента 1300 кг/м3 рецептура в привычных килограммах будет выглядеть следующим образом:
- 184 кг вяжущего или 3,68 мешка по 50 кг;
- 213 кг мелкого наполнителя;
- 197 кг крупного заполнителя (гравия).
Если используется другой крупный заполнитель, то ;вес последнего компонента будет отличаться: гранит — 192 кг, известняк — 183 кг, бут — 213 кг, базальт — 241 кг.
Для расчета количества мешков цемента нужно полученный вес разделить на количество килограммов в мешке. Например, для замешивания 1 кубометра бетона потребуется 4 мешка по 50 кг или 8 мешков по 25 кг.
Где взять рецепты бетонных смесей и ЦПС для составления пропорции компонентов и расчета? Рецептура для каждого типа раствора рассчитывается индивидуально, но обязательно с учетом ГОСТ 27006-2019. Рецепт должен быть таким, чтобы обеспечить приготовление раствора с заданными техническими характеристиками.
Рецепт должен быть таким, чтобы обеспечить приготовление раствора с заданными техническими характеристиками.
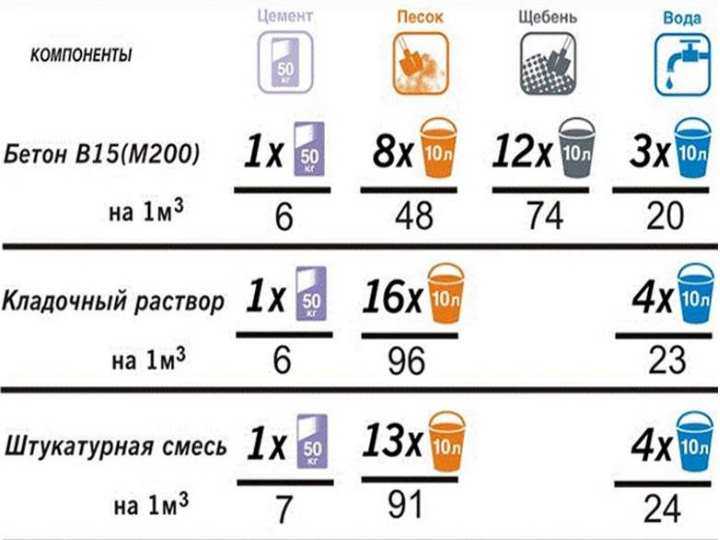
Основные виды растворов готовят по такой рецептуре с соотношением цемент/песок/щебень:
- Бетон М100 — 1/4,5/7 на портландцементе М400 или 1/5.8/8 на портландцементе М500.
- Бетон М250 — 1/2/4 на портландцементе М400 или 1/2,5/4,5 на портландцементе М500.
- Бетон М400 — 1/2,3/7 на портландцементе М400 или 1/1,5/3,2 на портландцементе М500.
Эту рецептуру можно использовать для производства товарного бетона, применяемого при строительстве домов, заливки фундаментов и чаш бассейнов, тротуарных дорожек, изготовления бордюрного камня, буронабивных свай.
Сколько весит 1 куб готового раствора?
Вес одного кубометра готового строительного раствора имеет значение при его транспортировке или подачи на высоту, когда подбирается грузоподъемность автомобиля или производительность бетононасоса. Вес жидкого бетона и цементно-песчаного раствора зависит от плотности компонентов, входящих в его состав и пропорции, в которой они использовались. При использовании тяжелых крупных заполнителей, таких как гранит, базальт, магнетит вес 1 м3 бетонной смеси может в 2-3 раз отличаться от массы раствора, замешанного на гравии.
При использовании тяжелых крупных заполнителей, таких как гранит, базальт, магнетит вес 1 м3 бетонной смеси может в 2-3 раз отличаться от массы раствора, замешанного на гравии.
Средний вес 1 кубического метра бетонной смеси по ГОСТ 7473-2010, замешанного на гранитном заполнителе, в зависимости от марки и класса прочности будет следующим:
- М100 (В7.5) — 2494 кг;
- М200 (В15) — 2432 кг;
- М250 (В20) — 2348 кг;
- М300 (В22,5) — 2389 кг;
- М350 (В25) — 2502 кг;
- М400 (В30) — 2376 кг;
- М500 (В40) — 2980 кг.
Вес 1 м3 бетонного раствора, замешанного на других заполнителях по СНиП II-3-79:
- железобетон — 2500 кг;
- туфобетон — 1200…1400 кг;
- пемзобетон — 800…1600 кг;
- на вулканическом шлаке — 800…1600 кг;
- керамзитопенобетон — 500…1800 кг;
- шунгизитобетон — 100…1400 кг;
- перлитобетон — 600…1200 кг;
- термозитобетон — 1000.
 ..1800 кг;
..1800 кг; - на доменных гранулированных шлаках — 1200 кг;
- вермикулитобетон — 800…1000 кг;
- газо-, пенобетон, пеносиликат — 300…1100 кг.
Вес 1 куба строительных растворов по СНиП II-3-79 составляет:
- цементно-песчаный (ЦПС) — 1800 кг;
- цементно-песчано-известковый — 1700 кг;
- известково-песчаный — 1600 кг;
- цементно-шлаковый — 1400 кг;
- гипсовый — 1000 кг.
Расчет цемента для транспортировки
При транспортировке мешков цемента или насыпного порошка важно знать, сколько материала поместиться в той или иной машине. Например, для перевозки 10 м3 цемента потребуется два КАМАЗа грузоподъемностью 7 тонн или один 15-тонник.
Не менее важное значение имеет транспортировка материалов непосредственно на стройплощадке. При отсутствии бетононасоса материалы для замешивания раствора подаются, как правило, ведрами. Один кубический метр сухого цемента — это 84 10-литровых ведра или 50 20-литровые бадьи.
Для расчета того, сколько мешков можно привести в багажнике легкового автомобиля, нужно знать объем 1 мешка и вместимость багажника. Удельная плотность сухого цементного порошка — это вес 1 м3 материала. Средний показатель плотности составляет 1300 кг/м3. Для определения объема цемента в 50-киллограмовом мешке нужно решить пропорцию:
1300 кг/м3 — 100%
50 кг — Х%, отсюда Х = 3,85%. Именно такой процент от 1 кубометра содержится в мешке. Берем полученный процент от кубометра и получаем величину в привычных кубометрах — 0,0385 м3 или 38,5 литров. Зная объем багажника машины, можно рассчитать, сколько мешков туда теоретически можно загрузить. Именно теоретически, т. к. в реальных условиях нужно учитывать грузоподъемность автомобиля и способ укладки мешков с цементом.
Фасовка цемента
Производители фасуют цемент в мешки по 5, 10, 25 и 50 кг, давая покупателю возможность выбрать наиболее удобный и экономичный вариант. Если при расчете пропорции получилось, что для строительно-монтажных работ нужно 5,2 мешка цемента по 50 кг, то целесообразно купить 5 мешков по 50 и один 10 кг.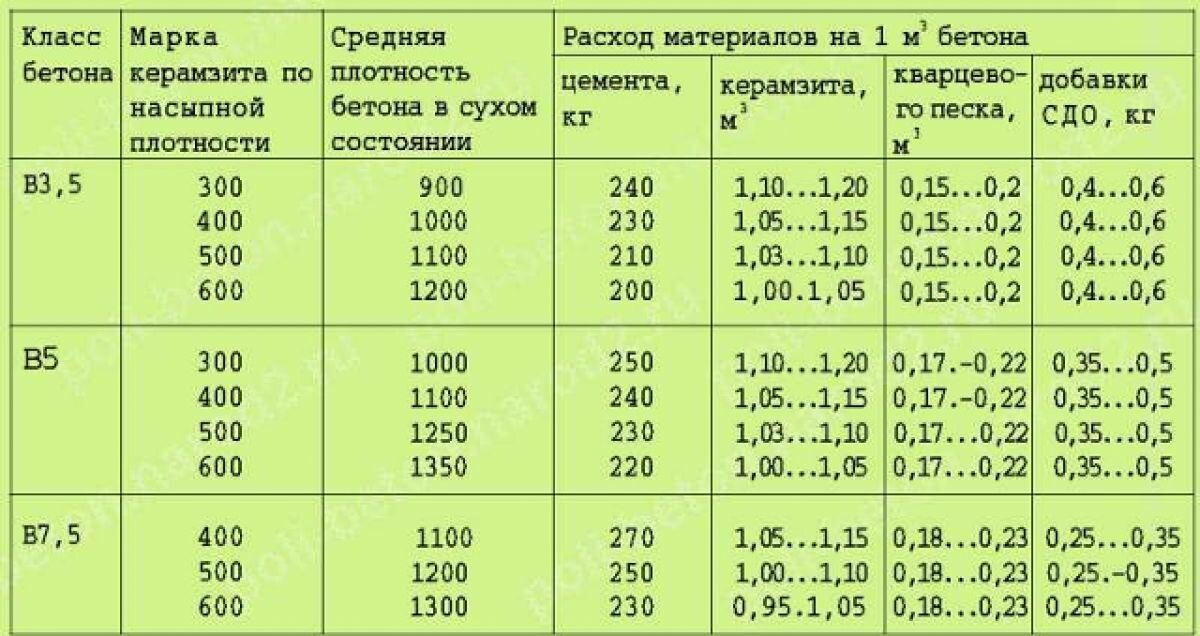 При расчетах не нужно забывать о технологических потерях и к любому полученному результату прибавлять 5-7%.
При расчетах не нужно забывать о технологических потерях и к любому полученному результату прибавлять 5-7%.
реакций в растворе — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 239
Раствор состоит из двух или более веществ, растворенных в жидкой форме. Не путать с смесь , которая является гетерогенной — существует несколько веществ с различной структурой — растворы гомогенны, что означает, что атомы растворенного вещества равномерно распределены по всему растворителю (например, вода, этанол). Думайте об этом как о сравнении чашки (растворенной) сахарной воды и чашки воды с кубиками лего. Растворенное вещество — это вещество, растворенное в растворе, а растворитель — вещество, осуществляющее растворение.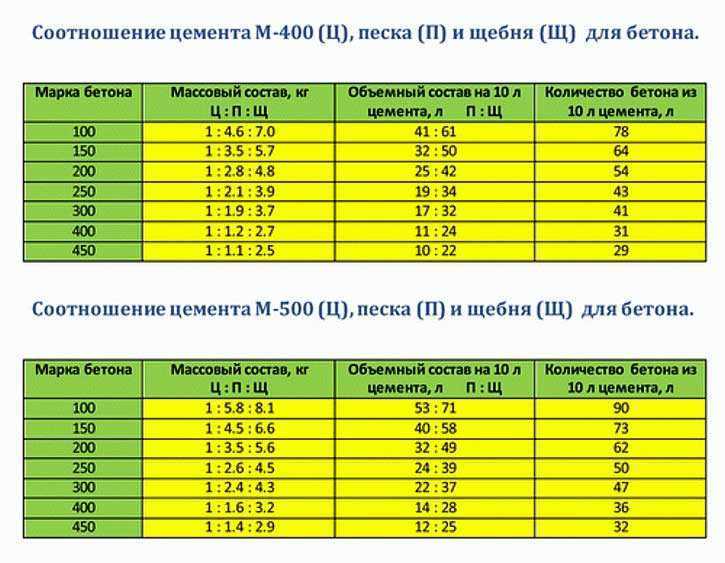
пр.
Раствор NaCl в воде Смесь кубиков лего и воды
Примечание. Все растворы являются смесями, но не все смеси являются растворами.
Растворители
Вода (H 2 O) является наиболее распространенным растворителем, используемым для растворения многих соединений или приготовления кофе. Другие распространенные растворители включают скипидар (разбавитель для краски), ацетон (средство для снятия лака для ногтей) и этанол (используется в некоторых духах). Такие растворители обычно содержат углерод и называются органическими растворителями. Растворы с водой в качестве растворителя называются водными растворами; у них есть особые свойства, которые рассматриваются здесь.
Растворенные вещества
Различные химические соединения растворяются в растворенных веществах в разной степени. Некоторые соединения, такие как сильная соляная кислота (HCl), полностью диссоциируют в растворе на ионы. Другие, такие как слабое основание аммиак (NH 3 ), только частично диссоциируют. Однако другие соединения, такие как спирт, вообще не диссоциируют и остаются соединениями. В лабораторных реакциях часто участвуют кислоты и основания, которые более подробно описаны здесь.
Однако другие соединения, такие как спирт, вообще не диссоциируют и остаются соединениями. В лабораторных реакциях часто участвуют кислоты и основания, которые более подробно описаны здесь.
Концентрация
Концентрация – это мера количества растворенного вещества в определенном количестве растворителя. Знание концентрации раствора важно, среди прочего, для определения силы кислоты или основания (pH). Когда концентрация растворенного вещества настолько велика, что он больше не растворяется, раствор считается насыщенным.
Ученые часто используют молярность для измерения концентрации.
молярность = моль/литр
Поскольку стехиометрия реакции зависит от молярных соотношений, молярность является основным показателем концентрации.
Менее распространенная единица концентрации называется моляльностью .
Моляльность = моль/кг растворителя
Ученые иногда используют моляльность для измерения концентрации, поскольку объемы жидкости незначительно изменяются в зависимости от температуры и давления. Однако масса остается неизменной и может быть точно измерена с помощью весов. Коммерческие концентрированные продукты обычно выражают в процентах по массе; например, техническая концентрированная серная кислота, содержащая 93-98% H 2 SO 4 по массе в воде (Hill, Petrucci 116).
Однако масса остается неизменной и может быть точно измерена с помощью весов. Коммерческие концентрированные продукты обычно выражают в процентах по массе; например, техническая концентрированная серная кислота, содержащая 93-98% H 2 SO 4 по массе в воде (Hill, Petrucci 116).
Приготовление раствора
Растворы, используемые в лаборатории, обычно готовятся либо из твердых растворенных веществ (часто солей), либо из исходных растворов.
Чтобы приготовить раствор из твердых растворенных веществ, сначала рассчитайте, сколько молей растворенного вещества содержится в желаемых растворах (используя молярность). Рассчитайте необходимое количество твердого вещества в граммах, используя необходимые моли и молярную массу растворенного вещества, и взвесьте необходимое количество. Перенесите растворенное вещество в емкость (предпочтительно в мерную колбу, которая наиболее точно измеряет объем раствора, указанный на колбе) и добавьте небольшое количество растворителя. Тщательно перемешайте, чтобы растворенное вещество растворилось. Как только растворенное вещество растворится, добавьте оставшийся растворитель, чтобы получить раствор нужного объема, и тщательно перемешайте.
Тщательно перемешайте, чтобы растворенное вещество растворилось. Как только растворенное вещество растворится, добавьте оставшийся растворитель, чтобы получить раствор нужного объема, и тщательно перемешайте.
Например, чтобы получить 0,5 л 0,5-молярного NaCl:
1. Умножьте концентрацию (0,5 моль/л) на нужный объем раствора (0,5 л), чтобы найти необходимое количество молей NaCl.
0,5 моль/литр * 0,5 литра = 0,25 моля NaCl
2. Умножьте количество молей NaCl на его молярную массу (58,44 г/моль), чтобы найти необходимое количество растворенного вещества в граммах.
(0,25 моль NaCl)*(58,44 грамм/моль) = 14,61 грамм NaCl
Приготовление раствора определенной концентрации из исходного раствора называется разбавлением. При разбавлении раствора имейте в виду, что добавление растворителя к раствору изменяет концентрацию раствора, но не количество уже присутствующего растворенного вещества.
Чтобы разбавить раствор известной концентрации, сначала определите количество молей растворенного вещества в растворе, умножив молярность на объем (в литрах).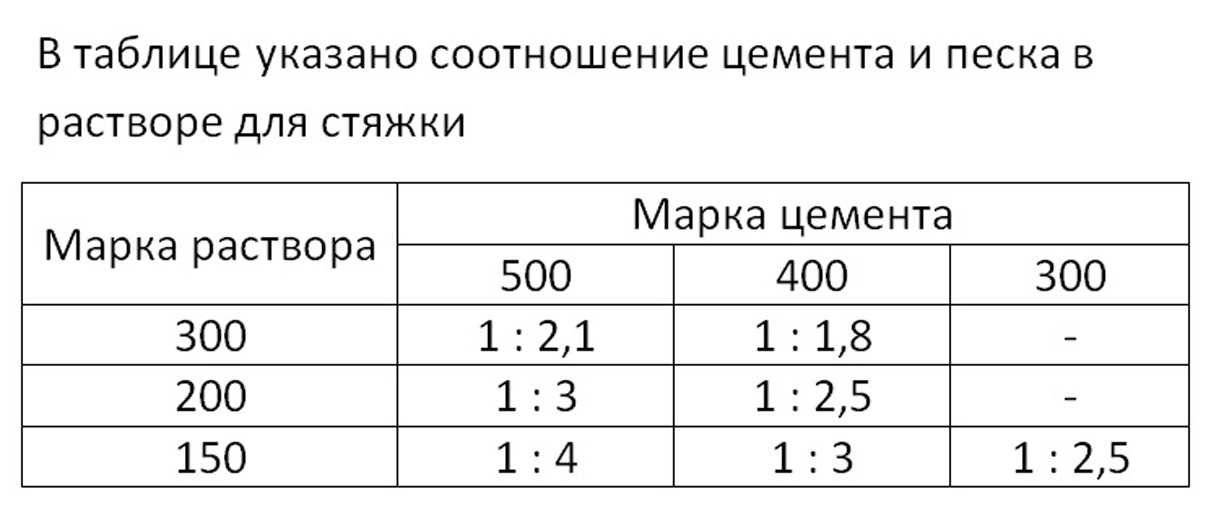 Затем разделите на желаемую молярность или объем, чтобы найти необходимый объем или концентрацию.
Затем разделите на желаемую молярность или объем, чтобы найти необходимый объем или концентрацию.
Нужно использовать простое уравнение:
M 1 V 1 = M 2 V 2
M 1 и В 1 — концентрация и объем исходного ) раствор для разбавления; М 2 и V 2 — желаемая концентрация и объем конечного раствора.
Стехиометрия раствора
Для реакций, происходящих в растворах:
- Рассчитайте количество молей реагирующего растворенного вещества, умножив концентрацию (молярность) на объем раствора (литры)
- Определить предельный реагент, если он есть
- Следуйте стехиометрическому процессу.
- Преобразуйте полученные моли растворенного вещества обратно в молярность путем деления на общий объем в литрах раствора, использованного в реакции.
- В случае реакций с участием ионов (например, в реакциях между сильными кислотами и основаниями) исключите ионы-спектаторы из общего ионного уравнения.
 Ионы-спектаторы не реагируют в уравнениях.
Ионы-спектаторы не реагируют в уравнениях. - Если концентрация не указана, а указаны молярная масса и объем, используйте плотность (граммы/литр), чтобы найти количество растворенного вещества в граммах, а затем переведите его в моли.
Ссылки
- Хилл, Петруччи. Общая химия: комплексный подход, второе издание. Нью-Джерси: Прентис Холл, 19 лет.99.
- Петруччи, Харвуд, Херринг, Мадура. Общая химия: принципы и современные приложения, девятое издание. Нью-Джерси: Прентис Холл, 2007.
.
Внешние ссылки
- en.Wikipedia.org/wiki/Solvent
- http://en.Wikipedia.org/wiki/Molar_concentration
Проблемы
- Раствор готовят путем растворения 44,6 г ацетона (OC(CH 3 ) 2 ) в воде с получением 1,50 л раствора. Какова молярность полученного раствора?
- Для определенной лабораторной процедуры требуется 0,025 M H 2 SO 4 .
 Сколько миллилитров 1,10 M H 2 SO 4 нужно развести в воде, чтобы приготовить 0,500 л 0,025 M H 2 SO 4 ?
Сколько миллилитров 1,10 M H 2 SO 4 нужно развести в воде, чтобы приготовить 0,500 л 0,025 M H 2 SO 4 ? - Образец насыщенного NaNO 3 (водный) составляет 10,9 М при 25 градусах Цельсия. Сколько граммов NaNO 3 содержится в 230 мл этого раствора при той же температуре?
- Стакан со 175 мл 0,950 М NaCl оставляют открытым на некоторое время. Если к концу периода времени объем раствора в стакане уменьшился до 137 мл (потеря объема происходит за счет испарения воды), какова будет полученная концентрация раствора?
- Учащийся готовит раствор, растворяя 15,0 мл этанола (C 2 H 5 OH) в воде, чтобы получить раствор объемом 300,0 мл. Рассчитайте концентрацию (молярность) этанола в растворе. (плотность = 0,789 г/мл)
Решения
1.
2.
3.
4.
5.
Авторы и авторство
- Стефани Ши (UCD)
Reactions in Solution распространяется под лицензией CC BY-NC-SA 4. 0 и был создан, изменен и/или курирован LibreTexts.
0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- концентрация
- гетерогенный
- гомогенный
- молярность
- растворенное вещество
- решение
- Стехиометрия раствора
- растворитель
- стехиометрия
4.
 5: Концентрация растворов — Химия LibreTexts
5: Концентрация растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21718
Цели обучения
- Количественное описание концентрации растворов
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора равна количеству растворенное вещество , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (М) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора. Это эквивалентно количеству миллимолей растворенного вещества, присутствующего ровно в 1 мл раствора:
\[ молярность = \dfrac{моли\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитры\: из\: раствора} \label{ 4.5.1} \]
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно \(М\). Водный раствор, который содержит 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
\[[\rm{сахароза}] = 1,00\: M \номер\]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \label{4.5.2} \]
или
\[ V_{мл} M_{ммоль/мл} = \cancel{мл} \left( \dfrac{ммоль} {\cancel{мл}} \right ) = ммоль \label{4.5.3} \]
Рисунок \(\PageIndex{1}\) иллюстрирует использование уравнений \(\ref{4.5.2}\) и \(\ref{4.5.3} \).
Рисунок \(\PageIndex{1}\): Приготовление раствора известной концентрации с использованием твердого растворенного вещества
Пример \(\PageIndex{1}\): Расчет молей по концентрации NaOH
Расчет количества молей натрия гидроксида (NaOH) в 2,50 л 0,100 М NaOH.
Дано: идентичность растворенного вещества, объем и молярность раствора
Запрошено: количество растворенного вещества в молях
Стратегия:
Используйте либо уравнение \ref{4.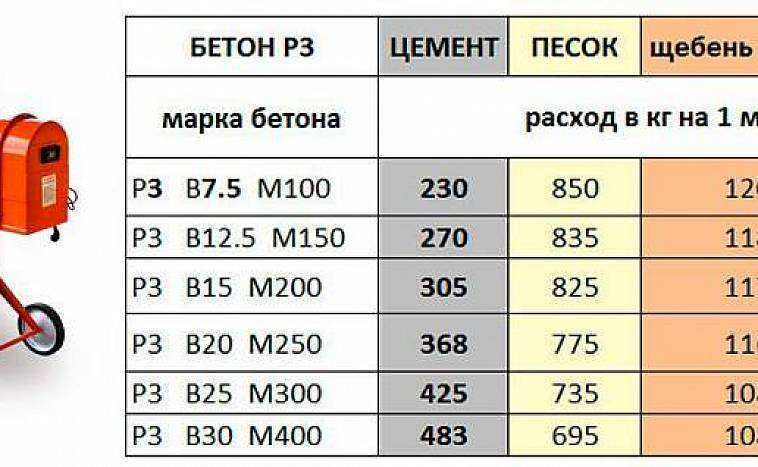 5.2}, либо уравнение \ref{ 4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
5.2}, либо уравнение \ref{ 4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
Решение:
Поскольку нам дан объем раствора в литрах и задано количество молей вещества, уравнение \ref{4.5.2} более полезно:
\( моль\: NaOH = V_L M_{моль/л} = (2,50\: \отменить{L}) \влево(\dfrac{0,100\: моль} {\отменить{L}} \вправо) = 0,250\: моль\: NaOH \)
Упражнение \(\PageIndex{1}\): Расчет молей по концентрации аланина
Рассчитайте количество миллимолей аланина, биологически важной молекулы, в 27,2 мл 1,53 М аланина.
- Ответить
41,6 ммоль
Расчеты с использованием молярности (M): расчеты с использованием молярности (M), YouTube (opens in new window) [youtu.be]
или на основе отношения массы к объему (m/v), особенно в клинических лабораториях и инженерных приложениях.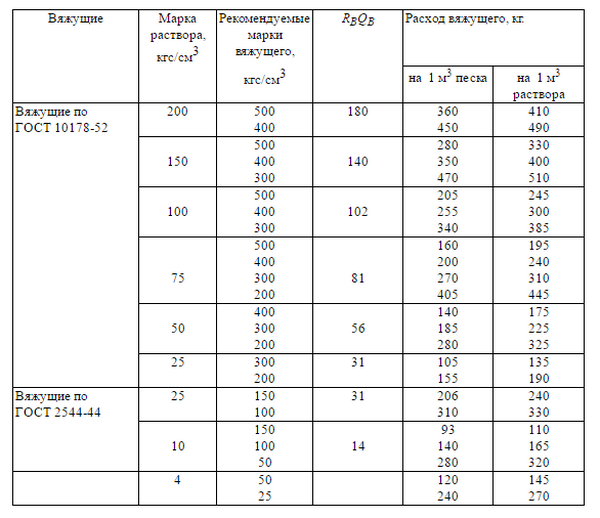 Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в Части на миллион ( ч / млн ), которые составляют граммы растворенного вещества на 10 6 г решения, или в частях на миллиард ( ppb ), которые представляют собой граммы раствора на 10 G из из решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в Части на миллион ( ч / млн ), которые составляют граммы растворенного вещества на 10 6 г решения, или в частях на миллиард ( ppb ), которые представляют собой граммы раствора на 10 G из из решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
| Концентрация | Единицы |
|---|---|
| м/м | г растворенного вещества/г раствора |
| т/х | г растворенного вещества/мл раствора |
| частей на миллион | г растворенного вещества/10 6 г раствора |
| мкг/мл | |
| частей на миллиард | г растворенного вещества/10 9 г раствора |
| нг/мл |
Приготовление растворов
Для приготовления раствора, содержащего определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора. На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок \(\PageIndex{2}\): Приготовление 250 мл раствора (NH 4 ) 2 Cr 2 O 7 в воде. Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды. 45 мл воды остается в мерном цилиндре даже после добавления до метки мерной колбы.
Пример \(\PageIndex{2}\)
Раствор содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 • 2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора.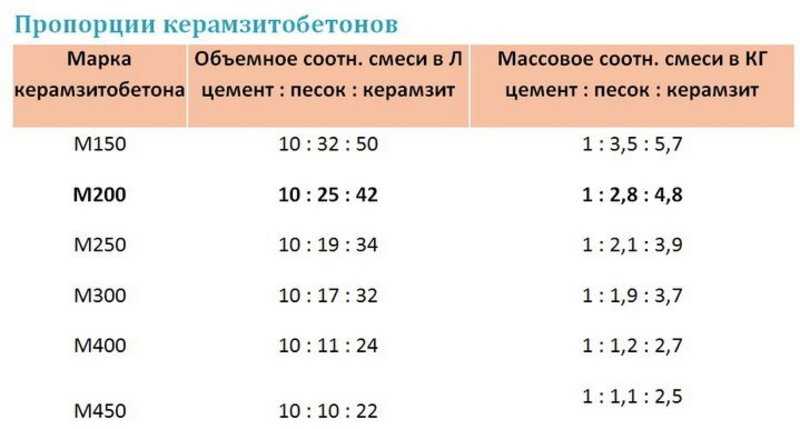 Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей \(\ce{CoCl2•2h3O}\), разделите масса соединения по его молярной массе. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 •2H 2 O составляет 165,87 г/моль. Следовательно,
\[ моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /mol} \right) = 0,0603\: моль \номер \]
Объем раствора в литрах равен
\[ объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0 .500\: L \nonumber \]
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\[ молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \номер\]
Упражнение \(\PageIndex{2}\)
Раствор, показанный на рисунке \(\PageIndex{2}\), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 900 39 дюймов достаточное количество воды, чтобы получить окончательный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Какова молярная концентрация дихромата аммония?
- Ответить
\[(NH_4)_2Cr_2O_7 = 1,43\: M \не число \]
Чтобы приготовить определенный объем раствора, который содержит указанную концентрацию растворенного вещества, нам сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \(\ref{4.5.2 }\). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \(\PageIndex{3}\).
Пример \(\PageIndex{3}\): Раствор D5W
Так называемый раствор D5W, используемый для внутривенного замещения жидкостей организма, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.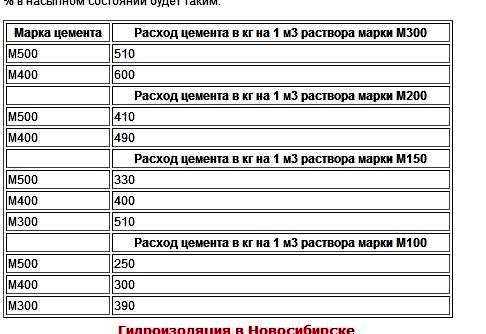
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив число молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \right) = 27,9 \: g \: глюкоза \)
Упражнение \(\PageIndex{3}\)
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
- Ответить
2,3 г NaCl
Раствор нужной концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рисунке \(\PageIndex{3}\). Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем меняет количество молей растворенного вещества в количестве , а не . Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0026
Помните, что разбавление заданного количества исходного раствора растворителем меняет количество молей растворенного вещества в количестве , а не . Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0026
\[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\метка{4.5.4} \]
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример \(\PageIndex{4}\) демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок \(\PageIndex{3}\): Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий требуемые моли растворенного вещества (M s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки [( V s )(M s ) = ( V d )(M d ) ].
Пример \(\PageIndex{4}\)
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере \(\PageIndex{3}\)?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в указанном объеме разбавленного раствора, путем умножения объем раствор по его молярности.
- Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Решение:
A Раствор D5W в примере 4.5.3 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\[ моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 . 775\: моль\: глюкоза \номер\]
775\: моль\: глюкоза \номер\]
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего такое количество глюкозы:
\[ объем\: из\: сток\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \номер\]
При определении необходимого объема маточного раствора мы должны были разделить желаемое количество молей глюкозы по концентрации исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 4.5.4 для V s и подставив соответствующие значения:
\[ V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2.500\: L)(0.310\: \cancel{M})} {3.00\: \cancel{M}} = 0.258\: L \nonumber \]
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение \(\PageIndex{4}\)
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответить
16 мл
Концентрация ионов в растворе
В примере \(\PageIndex{2}\) концентрация раствора, содержащего 90,00 г бихромата аммония в конечном объеме 250 мл, рассчитана как 1,43 М. Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля Cr 2 O 7 2 − анионов и 2 моль катионов NH 4 + (см. рисунок \(\PageIndex{4}\)).
рисунок \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Растворение 1 моля ионного соединения. В этом случае при растворении 1 моля (NH 4 ) 2 Cr 2 O 7 получается раствор, содержащий 1 моль Cr 2 O 7 2 − ионов и 2 моль NH 4 + ионов. (Молекулы воды опущены из молекулярного изображения раствора для ясности.) 1 моль дихромата аммония показан в мерной колбе объемом 1 л. Полученная мерная колба справа содержит 1 литр раствора после растворения в воде. Порошкообразная форма бихромата аммония также включена в схему.
При проведении химической реакции с использованием раствора соли, такой как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2 − 903 86 также должно быть 1,43 М, потому что есть один Cr 2 O 7 2 − ион на формульную единицу. Тем не менее, существует два иона NH 4 + на единицу формулы, поэтому концентрация NH 4 + ионы составляет 2 × 1,43 М = 2,86 М. Потому что каждая формула (NH 4 ) М. 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 90 385 2 − ), общая концентрация ионов в растворе 3 × 1,43 M = 4,29 M.
Тем не менее, существует два иона NH 4 + на единицу формулы, поэтому концентрация NH 4 + ионы составляет 2 × 1,43 М = 2,86 М. Потому что каждая формула (NH 4 ) М. 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 90 385 2 − ), общая концентрация ионов в растворе 3 × 1,43 M = 4,29 M.
Концентрация ионов в растворе из растворимой соли: концентрация ионов в растворе из растворимой соли, YouTube (opens in new window) [youtu.be]
Пример \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (CH 3 ) 2 CHOH
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.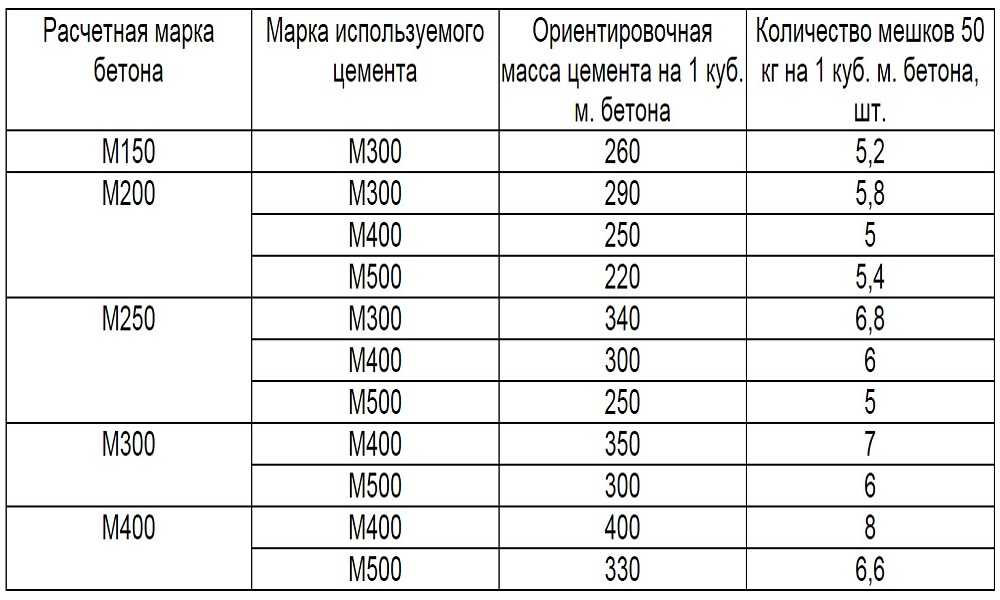 — (водн.) \)
— (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
9- (водн.) \)
B Одна формульная единица In(NO 3 ) 3 дает один ион In 3 + и три иона NO 3 − , поэтому 0,032 М В (№ 3 ) 3 раствор содержит 0,032 М In 3 + и 3 × 0,032 М = 0,096 М NO 3 – — то есть [In 3 903 85 + ] = 0,032 М и [NO 3 − ] = 0,096 М.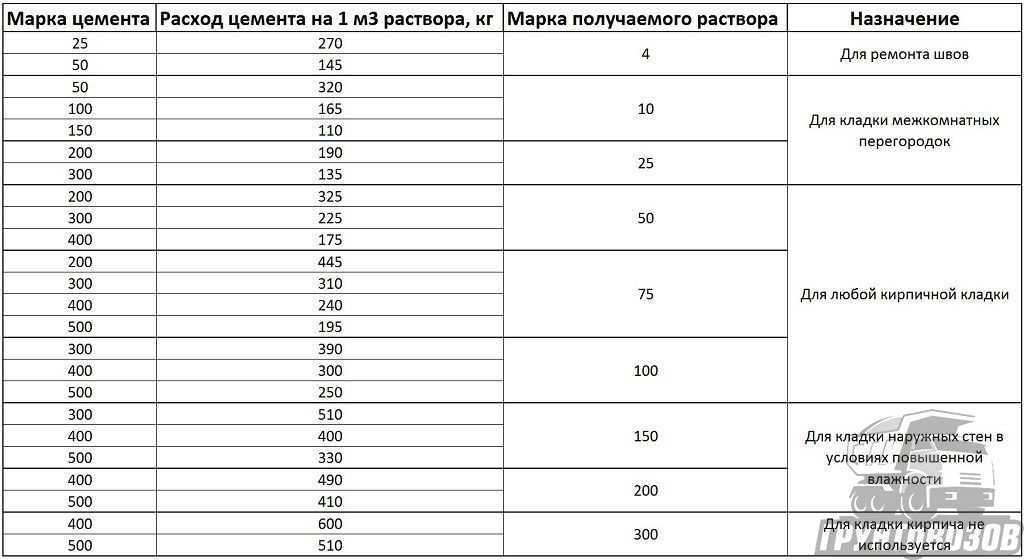
Упражнение \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, обычно известный как ацетон
Резюме
Концентрации растворов обычно выражаются в молях и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
- определение молярности: \[ молярность = \dfrac{моли\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитры\: из \: решение} \номер \]
- связь между объемом, молярностью и молями : \[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \nonumber \ ]
- связь между объемом и концентрацией основного и разбавленного растворов : \[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d) \номер\]
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражают в виде молярности , определяемой как количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор 9).0049 ) до желаемого конечного объема.
Концентрации обычно выражают в виде молярности , определяемой как количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор 9).0049 ) до желаемого конечного объема.
Авторы и авторство
4.5: Concentration of Solutions распространяется под лицензией CC BY-NC-SA 3.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.




 ..1800 кг;
..1800 кг; Ионы-спектаторы не реагируют в уравнениях.
Ионы-спектаторы не реагируют в уравнениях. Сколько миллилитров 1,10 M H 2 SO 4 нужно развести в воде, чтобы приготовить 0,500 л 0,025 M H 2 SO 4 ?
Сколько миллилитров 1,10 M H 2 SO 4 нужно развести в воде, чтобы приготовить 0,500 л 0,025 M H 2 SO 4 ?