Содержание
пропорции, как приготовить глиняный состав, глина и песок, как сделать, приготовление
Содержание:
Характеристики глины
Удаление примесей
Разновидности и способы приготовления растворов для печей
Особенности раствора для кладки печи из кирпича — как правильно приготовить
Подбираем пропорции компонентов для раствора
Чтобы кладка печи была прочная и долговечная, необходимо правильно подобрать раствор. Оптимальным материалом для этих целей служит обыкновенная глина, которая после термической обработки становится крепкой и отлично удерживает кладку. В данном материале речь пойдет о том, как сделать раствор для кладки печи, а также в каких пропорциях смешивать его компоненты.
Характеристики глины
Важнейшим параметром, по которому определяется качество глины, является ее жирность. Встречается жирная и тощая глина. По мере высыхания жирная глина сжимается и начинает трескаться, а тощая – рассыпается в крошку.
Строгие пропорции глины и песка для кладки печей определить достаточно сложно, поскольку раствор готовится экспериментальным путем в зависимости от жирности материала.
Чтобы выяснить, какая глиняная порода находится в вашем распоряжении, из нее необходимо скатать жгуты толщиной в 10-15 мм и длиной 15-20 см. Эти полоски оборачивают вокруг деревянного цилиндра сечением 50 мм. Жирная глина будет растягиваться постепенно, не растрескиваясь. Оптимальной для работы будет такая глина, жгуты из которой плавно растягиваются и рвутся, лишь увеличиваясь на 15-20 % первоначальной длины.
Удаление примесей
Поскольку в состав раствора для печи обязательно входит песок, его необходимо тщательно очистить. Сначала речной песок просеивают сквозь сито с ячейками в 1,5 мм, после чего промывают. Для промывки песка используется держатель с натянутым на нем с небольшим провисанием куском мешковины. В него засыпают песок, фиксируют приспособление на подставке и начинают промывать смесь струями воды из шланга. Промывку продолжают до тех пор, пока снизу не будет стекать чистая вода.
Промывку продолжают до тех пор, пока снизу не будет стекать чистая вода.
Используемая в растворе для кладки печи глина также должна быть очищена от дополнительных включений. Для этого ее также нужно промыть. Сначала породу дробят и выкладывают в верхней части длинной посудины – ванны или корыта. Емкости придают уклон в 4-8º. Внизу посудины наливают воду, чтобы она не соприкасалась с глиной. При помощи совка или лопаты глиняную породу начинают аккуратно омывать. В результате по мере размягчения глины в нижней части емкости образуется пастообразная смесь, которую помещают в другой резервуар. Промывку продолжают до тех пор, пока не соберется достаточное количество материала.
Чтобы приготовить раствор для кладки печки из сухой фасованной глины, ее необходимо размочить. Для придания материалу необходимой консистенции, сухую смесь насыпают в емкость на 10-20 см высоты, а затем заливают водой, чтобы полностью покрыть глину. Через 24 часа состав перемешивают, при необходимости – добавляют еще воды и оставляют в таком состоянии еще на сутки.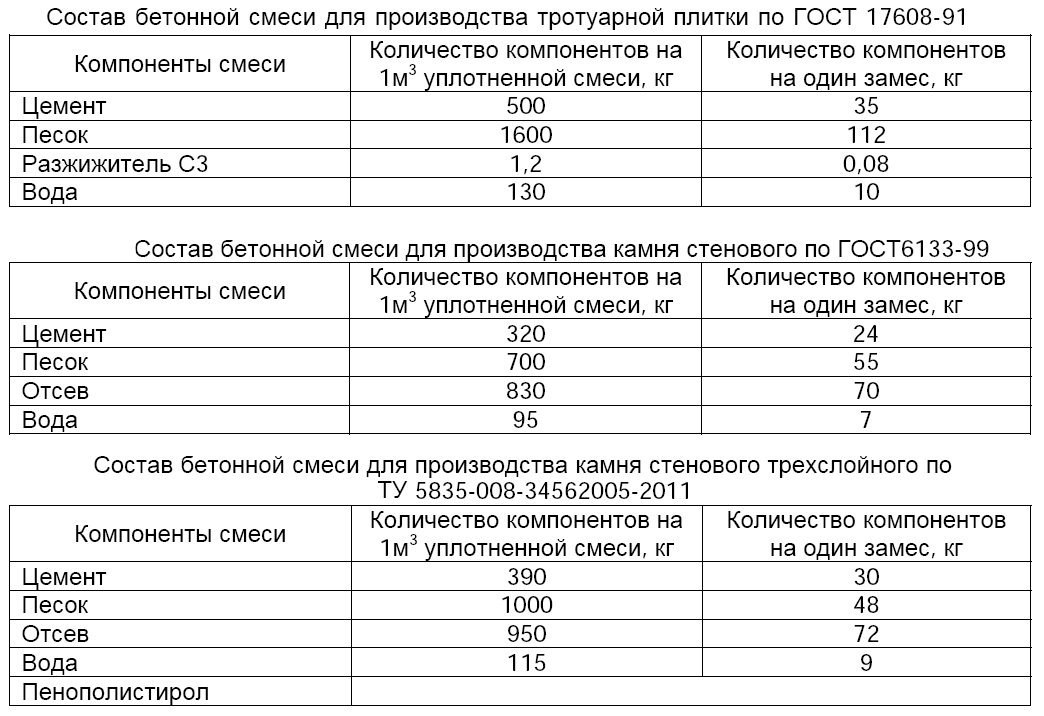 Как только вся смесь превратится в пастообразную массу, можно приступать к работе – глина готова. Таким способом получают достаточный объем материала.
Как только вся смесь превратится в пастообразную массу, можно приступать к работе – глина готова. Таким способом получают достаточный объем материала.
Разновидности и способы приготовления растворов для печей
На каждом технологическом этапе сооружения печи, будь то возведение фундамента, выполнение основной кладки или облицовочные и штукатурные работы, применяются различные типы растворов.
В частности, используются такие разновидности:
- глинистая смесь;
- глинисто-известковый состав;
- известковый раствор;
- смесь из цемента с песком.
Так как приготовить раствор для кладки печи нужно таким образом, чтобы он надежно удерживал кирпичи, для прочности в него добавляют цемент или немного поваренной соли. Однако нередко используют только глину и воду. Опытные мастера для удобства работы придумали небольшую хитрость – они сбивают широкий деревянный поддон с невысокими бортиками, в котором удобно перемешивать ингредиенты раствора.
Особенности раствора для кладки печи из кирпича — как правильно приготовить
Совет: Используйте наши строительные калькуляторы онлайн, и вы выполните расчеты строительных материалов или конструкций быстро и точно.
Перед тем, как сделать раствор для печи, нужно определиться с количеством необходимых ингредиентов. Например, для сооружения печи, на каждые 50 кирпичей, уложенные горизонтально широкой стороной со швами в 3-5 мм, расход раствора составит 20 литров. Для русской печи понадобится на 15-20 % больше кладочной смеси.
Обратите внимание, что глинистый раствор для печки может применяться не только для выполнения кирпичной кладки, но и для облицовочных работ. Иногда в него добавляют примеси в виде опилок, древесной стружки или песка. Для приготовления глинистого раствора для кладки печи из кирпича пропорции ингредиентов составят: 2 части глины к 1 части примесей. Преимущественно применяются глинисто-песчаные смеси.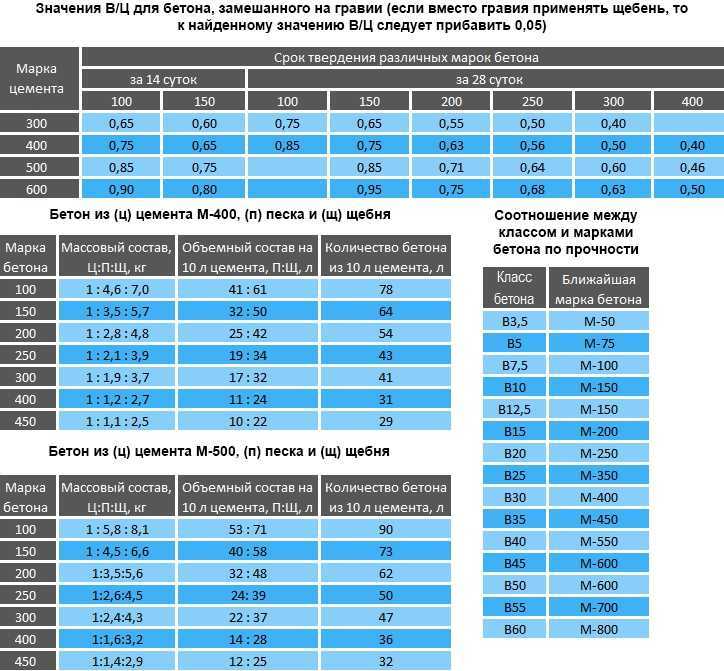
Все компоненты соединяют вместе и перемешивают до получения однородной сметанообразной консистенции. Раствор готов, если он свободно и без остатка соскальзывает с лопаты. Если же на лопате остаются следы воды, значит, в составе раствора для кладки печи недостает песка. Добавление соли из расчета 100-250 г на 10 литров смеси позволит обеспечить большую прочность кладки. Цемент при этом применяется реже – его требуется 750 г на тот же объем раствора.
Избавиться от неровностей и облицевать печь искусственным камнем, плиткой или мозаикой можно при помощи раствора из цемента и песка. Кроме того, он используется для укладки фундамента под печь и заполнения швов между кирпичами. Для приготовления раствора для кладки печей из песка и цемента необходимо сначала смешать сухие ингредиенты, а затем залить их водой и довести до консистенции, когда раствор свободно выдавливается из шва. Точное соотношение компонентов зависит от качества цемента, однако чаще всего берут 1 часть цемента на 2 части песка.
Штукатурные работы, а также укладка фундамента и печной трубы выполняется известковым раствором. В данном случае в первую очередь необходимо погасить известь – ее заливают водой и выдерживают в течение 7 дней. Затем смешивают песчаный раствор. В известковом растворе для кладки печей пропорции ингредиентов зависят от жирности извести – 1:2 или 1:3.
Как вариант, оштукатурить печь можно смесью из глины, извести и асбеста. Последний ингредиент придает кладке большую прочность.
Соотношение ингредиентов может быть таким:
- глина/известь/песок/асбест – 1:1:2:0,1;
- глина/цемент/песок/асбест – 1:1:2:0,1;
- гипс/песок/известь/асбест – 1:1:2:0,2.
Для того чтобы приготовить раствор по одному из таких рецептов, сначала смешивают сухие ингредиенты, а затем добавляют известковое тесто, гипс или разведенную глину. Раствор нужно размешать до получения однородной консистенции.
В некоторых случаях, например для выкладки ядра печи, применяется раствор из шамота и огнеупорной глины, смешанных в равных пропорциях. Воды требуется ¼ часть от количества глины. Обратите внимание, что состав должен быть пластичным и однородным, чтобы кирпичи хорошо соединились между собой.
Подбираем пропорции компонентов для раствора
Подбирая пропорции глиняного раствора для кладки печей, его пластичность и жирность можно подкорректировать количеством добавленного песка. Читайте также: «Как сделать глиняный раствор для кладки печи – особенности и нюансы изготовления кладочной смеси».
Получить оптимальные пропорции раствора из глины для кладки печей можно несколькими способами:
- Небольшое количество глины разделяют на 5 порций. Первую оставляют в исходном виде, а к остальным добавляют песок по ¼, ½, 1½ и 1 части. В каждую смесь доливают воды и замешивают, формируя небольшие блинчики.
 Состав не должен приставать к ладоням. После просушки блинчиков оценивают результаты. Недостаток песка приведет к образованию трещин, а при его излишке глина раскрошится. Наилучшим считается тот вариант, при котором поверхность заготовки останется ровной и без трещин.
Состав не должен приставать к ладоням. После просушки блинчиков оценивают результаты. Недостаток песка приведет к образованию трещин, а при его излишке глина раскрошится. Наилучшим считается тот вариант, при котором поверхность заготовки останется ровной и без трещин. - Чтобы сэкономить время, можно взять мастерок и опустить его в готовый раствор. В случае приставания смеси к инструменту, необходимо добавить песка, поскольку глина жирная. Если же мастерок практически не пачкается – смесь можно применять.
- Готовый глинистый раствор можно оставить постоять. В случае если на поверхности раствора появится излишек воды, значит, нужно добавить глины, так как она тощая.
- Возьмите 10 литров глиняной породы и размешайте с водой до консистенции сметаны. Возьмите деревянную рейки и опустите ее в раствор. Если на палку налипнет слой раствора толщиной в 1 мм, значит, досыпьте еще глины. Слишком толстый слой говорит о том, что в растворе мало песка – добавлять его нужно по 1 литру на ведро.
 Достаточный уровень жирности будет при налипании на дерево 2 мм слоя раствора.
Достаточный уровень жирности будет при налипании на дерево 2 мм слоя раствора.
Когда необходимые пропорции ингредиентов для раствора будут определены, можно перейти к подготовительному этапу перед кладкой печи.
Состав раствора для кладки печи
Чтобы построить печь, для ее кладки, нужно приготовить соответствующий и, что немаловажно, качественный раствор. Он представляет собой смесь, которая образуется путем соединения вяжущего вещества, компонентами заполнителя и воды.
При кладке печей чаще всего используют раствор из глины, поскольку он по своему составу больше всего подходит для керамического кирпича. Для возведения фундамента дымохода необходима смесь с иным составом, к примеру, известковая или бетонная. Они более прочные и не трескаются от собирающегося конденсата.
От уровня качества раствора и от толщины его швов напрямую зависит состояние и срок эксплуатации печки. Самое главное требование к нему — застывший раствор не должен трескаться и выкрашиваться. Для хорошего функционирования печки швы должны быть тонкими. Готовить раствор необходимо исключительно из чистых и качественных материалов.
Для строительства печки можно использовать следующие виды растворов:
Содержание
1 Глиняный раствор
1.1 Варианты приготовления раствора
1.2 Проверка пластичности глины
1.3 Проверка качества раствора
1.4 Приготовление глиняного раствора: Видео
2 Известковый раствор
3 Цементный раствор
Глиняный раствор
Глиняные растворы характеризуются их жирностью. От этого зависит их пластичность, устойчивость к высоким температурам, прочность и усадка.
Растворы из глины могут быть:
- жирные, которые имеют хорошую пластичность, но растрескиваются сильно при высыхании;
- тощие, обладающие непластичными и непрочными свойствам, при высыхании крошатся;
- нормальные— пластичны, при высыхании почти не растрескиваются, дают небольшую усадку.

Для надежной кирпичной кладки необходим нормальный уровень пластичности раствора, поскольку он выдерживает температуру 100 градусов.
Для приготовления раствора собираем материалы :
- Вода
- Глина
- Песок
Приготовление проводится чистой, слабоминерализованной водой, не содержащей ила. Если в воде растворено много минеральной соли, больше вероятности того, что на поверхности штукатурки печи появятся пятна, которые проступают через не одноразовую побелку. В далекие времена для кладки печи традиционно использовали дождевую воду.
Очищают песок от гравия, травы, корней просевая его через сито. Просеянный мелкий песок обеспечит тонкий шов кладки. Количество песка, необходимого для замеса раствора, зависит от того, какого качества используется глина.
Пластичность глины можно определить несколькими способами, которые будут описаны ниже в статье. Просеваем через сито глину, чтобы она была однородной консистенции и очищенная от мусора.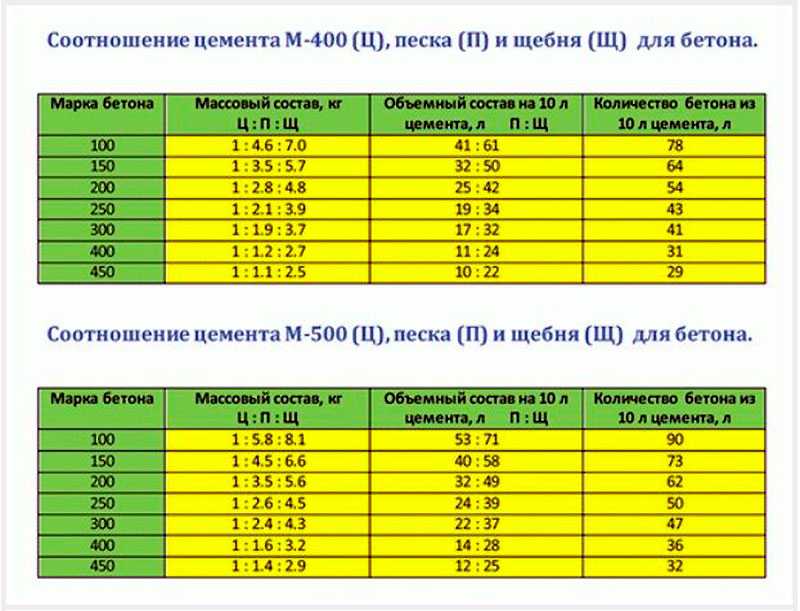
Варианты приготовления раствора
Рассмотрим несколько способов приготовления раствора для кладки.
Первый способ
Замачиваем глину за сутки до кладки, потом добавляем воду, доводя ее до густоты сметаны. Процеживаем раствор, добавляем песок и тщательно перемешиваем. Лужи жидкой глины не должны появляться на растворе, а если появились, то добавляем песок и снова перемешиваем.
Второй способ
Изготавливаем раствор для кладки кирпича. Смешиваем песок шамот с огнеупорной глиной в равном соотношении, потом добавляем воду, которая составляет четвертую часть глины, и тщательно перемешиваем. Это очень простой в выполнении метод.
Третий способ
Можно сделать раствор для кладки печи из суглинков. Чтобы получилось правильное соотношение компонентов, замешиваем десять вариантов раствора (каждого по спичечному коробку). Первый вариант — десять частей суглинка, по одной части песка и цемента; второй — суглинка девять частей, песка 2 части, одна часть цемента и так дальше до десятого варианта — одна часть суглинка, десятая часть песка, одна часть цемента.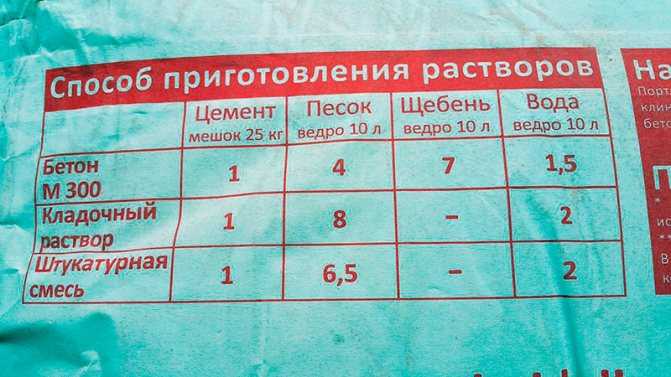 Растворами наполняем коробки и неделю сушим. Затем выбираем раствор, который не потрескался и имеет больше глины. Такой раствор быстро сохнет, при нагреве обжигается. За счет спекания глиняно-песчаной смеси образуется керамика. Данный раствор выдерживает температуру до 600 градусов. При высшей температуре он разрушается. Можно класть из него топки, которые будут работать на дровах, торфе.
Растворами наполняем коробки и неделю сушим. Затем выбираем раствор, который не потрескался и имеет больше глины. Такой раствор быстро сохнет, при нагреве обжигается. За счет спекания глиняно-песчаной смеси образуется керамика. Данный раствор выдерживает температуру до 600 градусов. При высшей температуре он разрушается. Можно класть из него топки, которые будут работать на дровах, торфе.
Четвертый способ
Если глина чистая и не имеет камней, добавляем к ней пересеянный мелкий песок и ¼ объема воды. В этом случае необходимо тщательно перемешивать глину и песок.
Раствор из глины должен быть сметанообразной густоты, не растекаться и хорошо сползать с лопаты. Для прочности можно добавить соль или цемент. На ведро раствора добавляем 100 — 250 грамм соли, а цемента ¾ литра. Соль растворяем в воде, а цемент заливаем водой до густоты сметаны, и потом добавляем в раствор. Качественный раствор обеспечит хорошее сцепление кладки и заполнение неровностей кирпича, что сделает шов плотным и газонепроницаемым.
Проверка пластичности глины
Для проверки глины на качество, советуем несколько проверенных способов:
Первый способ основан на глине разной пластичности, которая по-разному сседается на поверхности из дерева. Десять литров воды наливаем в ведро и добавляем глину до получения сметанообразного раствора, помешивая его очищенной дощечкой. Если на ней остается толстый слой глины, то раствор слишком пластичный. Необходимо добавлять песок из расчета: одна литровая банка на ведро раствора, пока он не будет нормальной пластичности. Раствор считается нормальной пластичности, когда на дощечке остается слой глины 2 миллиметра, и прилипает к ней сгустками. Если дощечка покрывается тонким слоем 1 миллиметр, то раствор малопластичный.
Второй способ заключается в механическом испытании раствора после высыхания. Очищаем глину от больших кусков и банкой, емкостью 1 литр, отмеряем пять ровных порций. В среднепластичную глину добавляем песок в пропорциях: первую оставляем без песка, вторую смешиваем с ¼ банки, в третью добавляем ½, в четвертую — целую банку, в пятую — 1,5 банки песка.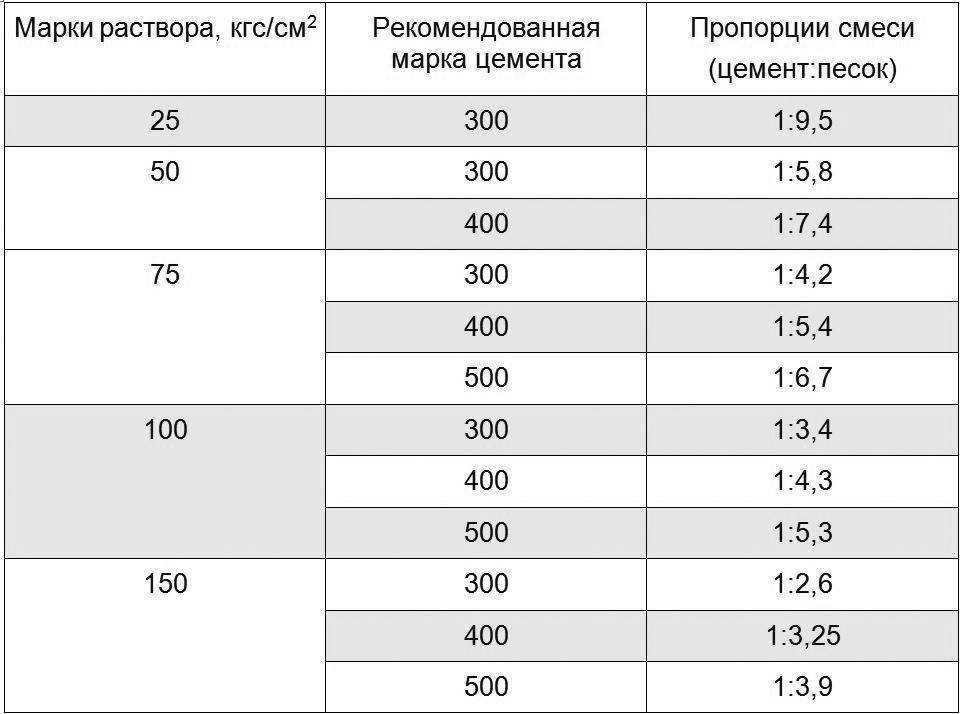 Каждую смесь разводим водой, чтобы глина не прилипала к рукам, но хорошо разминалась. Из полученных растворов лепятся шарики, которые потом нужно смять в лепешки. Эти лепешки должны высохнуть, главное не перепутать, где какой раствор. Те, в которых песка мало, будут трескаться, а в которых слишком много — крошиться. Оптимальным считается тот состав, из которого получилась плотная и не потрескавшаяся лепешка.
Каждую смесь разводим водой, чтобы глина не прилипала к рукам, но хорошо разминалась. Из полученных растворов лепятся шарики, которые потом нужно смять в лепешки. Эти лепешки должны высохнуть, главное не перепутать, где какой раствор. Те, в которых песка мало, будут трескаться, а в которых слишком много — крошиться. Оптимальным считается тот состав, из которого получилась плотная и не потрескавшаяся лепешка.
Для третьего способа необходимо, как и для второго, приготовить шарики. После их высыхания, берутся две отструганные дощечки. Шарик ложится на одну из них, а второй сверху придавливается. Где оптимальный состав раствора — тот начнет пускать трещины, когда сжать его на 1/3 от диаметра. Жирный раствор потрескается на половине диаметра, а тощий — практически сразу раскрошится.
Проверка качества раствора
Чтобы кирпичная кладка печи хорошо держалась, раствор должен быть качественно приготовлен в оптимальном соотношении компонентов. Как уже писалось выше, количество песка зависит от уровня пластичности глины. В связи с этим следует определить, сколько песка необходимо добавить.
Как уже писалось выше, количество песка зависит от уровня пластичности глины. В связи с этим следует определить, сколько песка необходимо добавить.
Пять отдельно взятых банок жирной глины нужно смешать с песком в пропорциях: первую порцию оставляем, во вторую добавляем полбанки песка, одну банку в третью, полторы в четвертую, в пятую — две. Перемешивая глину с песком, в каждую порцию добавляется вода. Раствор не должен прилипать к пальцам. Потом из каждого вида раствора скатывается по пять шариков, диаметром три — пять миллиметров. Необходимо взять по два шарика каждой смеси, сделать из них тоненькие лепешки и оставить сушиться на 12 суток в помещении. Из высохших шариков и лепешек проводим испытание таким образом: берем шарики и лепешки, и с высоты один метр бросаем их по очереди. Если при падении шарики и лепешки не растрескиваются и не разбиваются, значит это качественный раствор. Главное запомнить, из какой именно смеси изготовлен каждый шарик.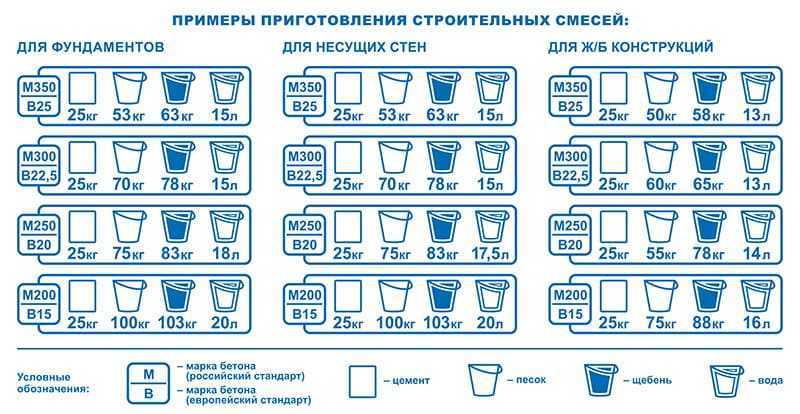
Проверить раствор из глины можно при помощи жгутов, изготовленных из него. Раскатываем глину, делаем жгуты диаметром около полтора сантиметра и длиной пятнадцать — двадцать сантиметров. Затем жгуты растягиваем и наматываем на деревянную круглую палочку, диаметром пять сантиметров. Если жгут обрывается в момент уменьшения толщины на пятнадцать — двадцать процентов от первоначального диаметра, то он сделан из хорошей глины.
Приготовление глиняного раствора: Видео
Известковый раствор
Для возведения дымохода и фундамента печки глиняная смесь не подходит. В той части дымохода, которая расположена над кровлей, собирается конденсат. Из-за него глина может давать трещины. При строительстве фундамента глиняный раствор недостаточно прочный. Лучше всего в таких целях применять в качестве основы известковое тесто.
Такое тесто производится путем смешивания воды и негашеной извести в соотношении 3:1. Самостоятельно не рекомендуется его изготавливать, поскольку это может привести к травмированию кожи и дыхательных путей. Лучше приобрести готовое известковое тесто в любом строительном магазине.
Самостоятельно не рекомендуется его изготавливать, поскольку это может привести к травмированию кожи и дыхательных путей. Лучше приобрести готовое известковое тесто в любом строительном магазине.
Чтобы приготовить раствор, необходимо просеять песок и протереть тесто через сито. Затем нужно смешать одну часть теста с тремя частями песка. Для получения необходимой консистенции добавляют воду.
Для повышения прочности кирпичной кладки, можно использовать известково-цементный раствор. Для его приготовления берем цемента одну часть, известкового теста — две, песка — десять. Сначала перемешиваем песок и цемент. Тесто разбавляем водой до состояния вязкости. Потом добавляем смесь песка и цемента в известковое молоко и перемешиваем. При необходимости снова добавляем небольшими порциями воду.
Цементный раствор
Для возведения дымохода и фундамента для печи используют также цементный раствор. Он отличается высокой прочностью и быстрым застыванием. Его готовят путем смешивания песка и цемента.
Его готовят путем смешивания песка и цемента.
Изначально сухой песок необходимо просеять, чтобы он был чистым и рассыпчатым. Затем берем песок и цемент. Соотношение зависит от марки цемента. Хорошо их перемешиваем, чтобы не было цементных комков. Перед использованием в смесь добавляем воду до создания необходимой густоты. Раствор не должен сползать с лопаты, но быть подвижным.
Цементный раствор необходимо использовать в течение одного часа, потому что он быстро схватывается и становится непригодным.
При строительстве печи, качество раствора для кирпичной кладки имеет очень большое значение. Если неправильно его приготовить, печь может пропускать дым, иметь плохую тягу, трескаться и разваливаться. В связи с этим, чтобы устройство для обогрева успешно выполняло свою прямую функцию и не создавало проблем, его строительство следует выполнять тщательно и аккуратно.
- Автор: alexandr-stepanenko
- Распечатать
Оцените статью:
(52 голоса, среднее: 4.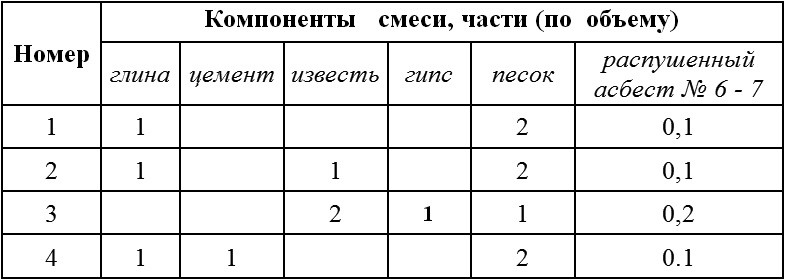 1 из 5)
1 из 5)
Поделитесь с друзьями!
Глава 12.1: Подготовка растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 19928
Цель обучения
- Количественно описать концентрации растворов.
В разделе 9.3 мы описали различные способы характеристики концентрации раствора, молярности (M), моляльности (m), концентрации в процентах и мольной доли (X). Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0024
Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0024
Приготовление растворов
Для приготовления раствора, содержащего указанную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\( Молярность раствора = dfrac{моли\: of\: solute}{Объем раствора} \tag{12.1.1}\)
На рис. 12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рис. 7 в воде
Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.
Пример 12.1.1
Раствор на рис. 12.1.1 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O? ·
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (М)
Стратегия:
Чтобы найти число молей CoCl 2 900 54 О, разделить массу соединения на его молярную массу. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 ·2H 2 O составляет 165,87 г/моль.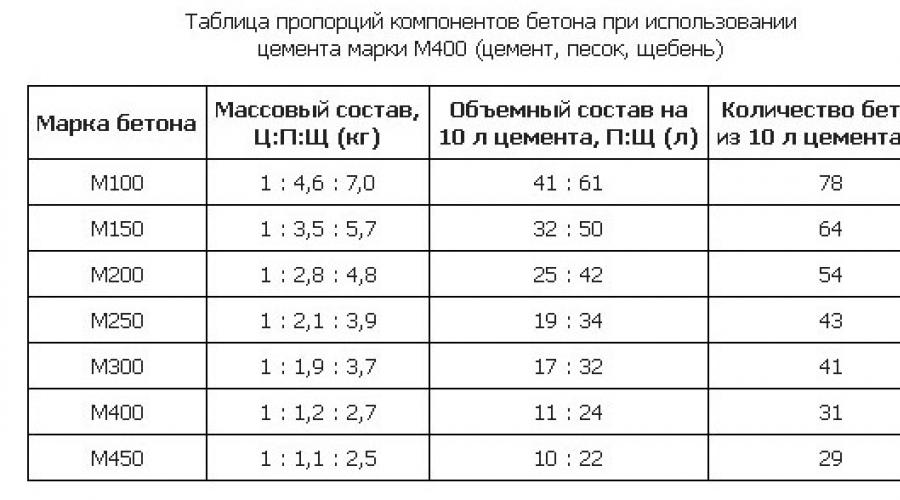 Следовательно,
Следовательно,
\( молей\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165 ,87\: \cancel{g} /mol} \right) = 0,0603 \: моль \)
Объем раствора в литрах равен
\( объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \справа) = 0,500\: л \)
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\( молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \)
Упражнение
Раствор, показанный на рис. 12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1,43 M
количество молей растворенного вещества в требуемом объеме раствора с использованием соотношения, показанного в уравнении 12. 1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.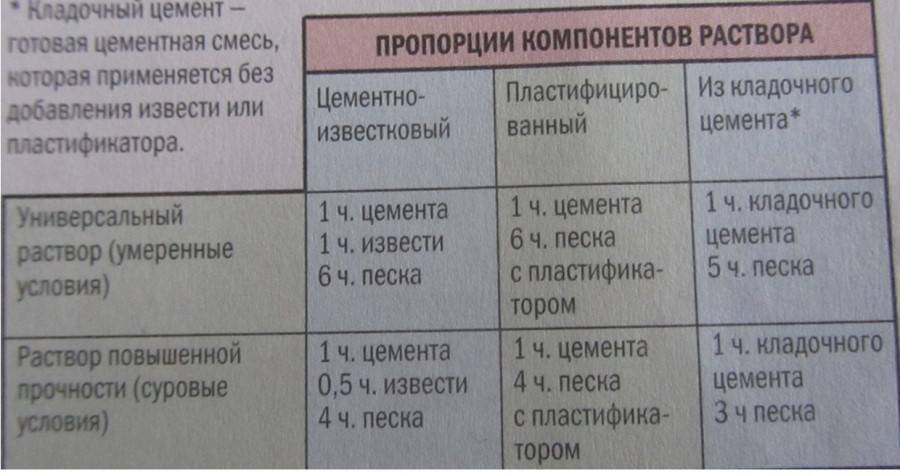
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \справа) = 27,9 \: г \: глюкоза \)
Упражнение
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор нужной концентрации можно также приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рис. 12.1.3. Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9. 0024
0024
\((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\tag{12.1.2}\)
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора. Рис. 12.1.3 Приготовление раствора известной концентрации путем разбавления маточного раствора0053 s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример 12.1.3
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере 4?
Дано: объем и молярность разбавленного раствора
Запрошено: объем основного раствора
Стратегия:
A Рассчитайте количество молей разбавленного раствора глюкозы, содержащееся в нем. умножение объема раствора на его молярность.
умножение объема раствора на его молярность.
B Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Раствор:
A Раствор D5W в примере 4 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\( моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \)
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего это количество глюкозы:
\( объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \)
При определении необходимого объема исходного раствора нам нужно было разделить желаемое количество молей глюкозы на концентрацию исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 12.1.2 для V s и подставив соответствующие значения:
\( V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \cancel{M}} = 0,258\: L \)
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
Ответ: 16 мл
Концентрация ионов в растворе
В разделе 9. 3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
3 мы рассчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моль Cr 2 O 7 2− анионов и 2 моль катионов NH 4 + (см. рис. 12.1.4).
Рисунок 12.1.4 Растворение 1 моля ионного соединения В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 O 7 1 моль Cr 2 O 7 2− ионов и 2 моль NH 4 + ионов. (Для ясности молекулы воды опущены в молекулярном представлении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. . Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
Пример 12.1.4
полученные из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора. 9- (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами.
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3,7 M. — (водн.) \)
— (водн.) \)
B Одна формульная единица In(NO 3 ) 3 дает один ион In 3 + и три иона NO 3 − In 0,0 054 ) 3 раствор содержит 0,032 М In 3 + и 3 × 0,032 М = 0,096 М NO 3 – – то есть [In 3 + + ] 3 − ] = 0,096 М.
Упражнение
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Ответ:
- [Ba 2 + ] = 0,0012 М; [ОН — ] = 0,0024 М
- [Na + ] = 0,34 М; [ТАК 4 2− ] = 0,17 М
- [(СН 3 ) 2 СО] = 0,50 М
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- НХ 3
- ВЧ
- СН 3 СН 2 СН 2 ОН
Нет 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет 3 Заказ на поставку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m . Моляльность определяется как число молей растворенного вещества в 1 кг растворителя .
 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.Каковы преимущества использования растворов для количественных расчетов?
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1,592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.

- 0,1065 М BaI 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3,62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.

- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента потребовалось 200,0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.
 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ) растворяют в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетках некоторых лекарств указаны инструкции по добавлению 10,0 мл стерильной воды, в которых указано, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
0,48 М ClO −
1,74 × 10 −3 М кофеин
- Анонимно
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Встроить Hypothes.is?
- да
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- да на странице
- Этап
- Финал
- Теги

- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47557
- Ed Vitz, John W. Moore, Justin Shorb, Xavier Prat-Resina, Tim Wendorff, & Adam Hahn ДЛ)
- Объяснить, как можно изменить концентрацию в лаборатории.
- Понимать, как в лаборатории используются стандартные растворы.
- Разбавленный раствор — это раствор, в котором растворено относительно небольшое количество растворенного вещества.
- Концентрированный раствор содержит относительно большое количество растворенного вещества.
- \(V_1\) и \(V_2\) — объемы двух растворов
Уравнение 12.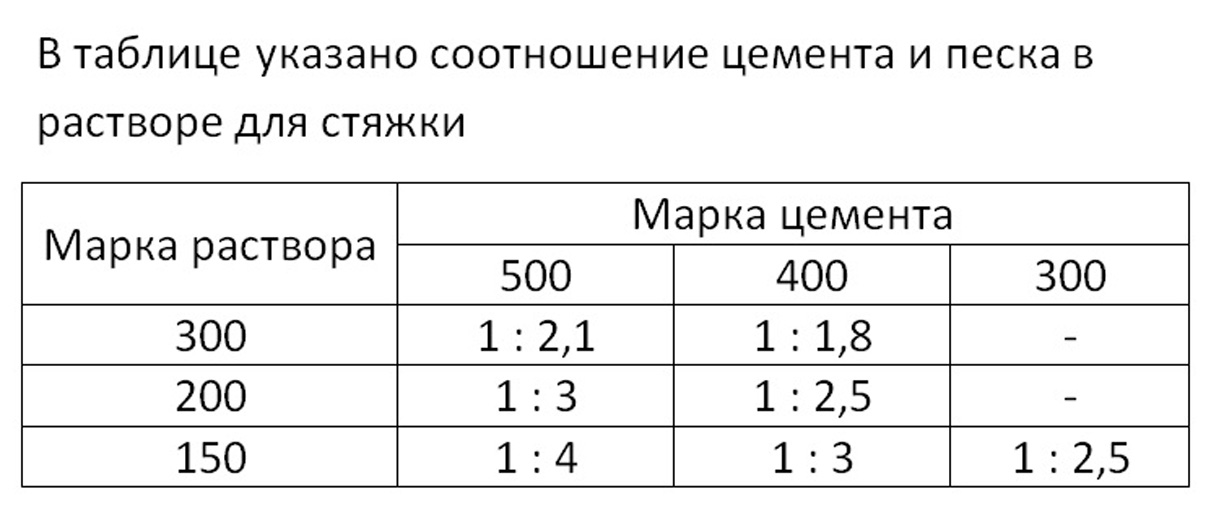 1.2:
1.2:
Резюме
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражаются как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходный раствор ) до желаемого конечного объема.
Key Takeaway
Концептуальные проблемы
Ответить
Численные задачи
Ответы
Авторы
Изменено Джошуа Халперном, Скоттом Синексом и Скоттом Джонсоном
Глава 12.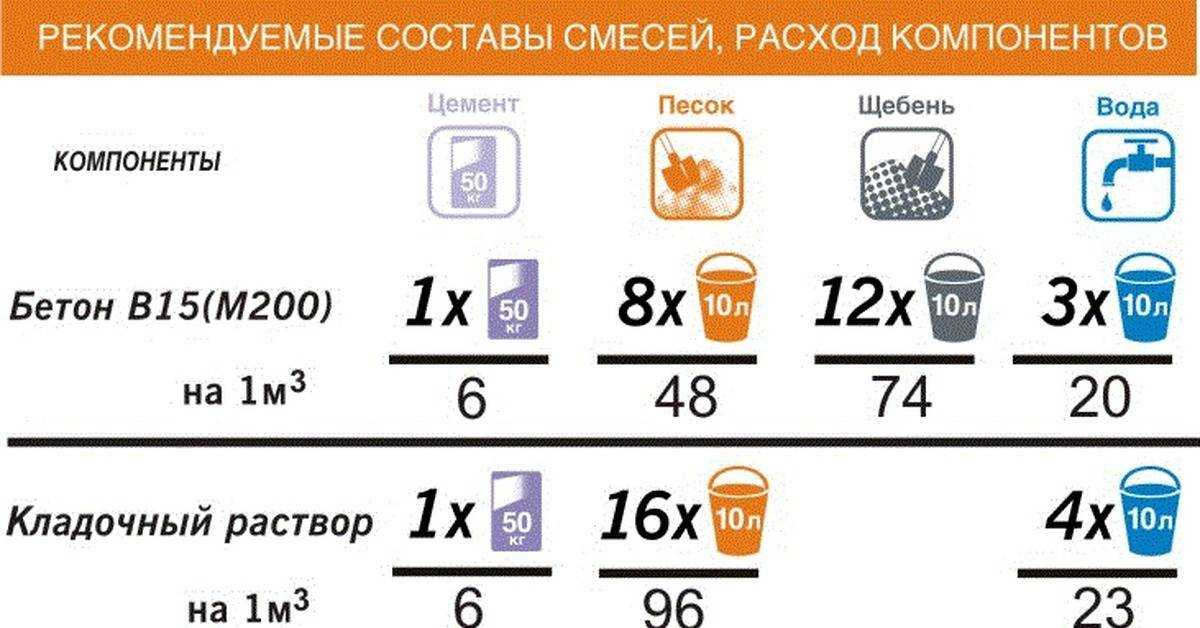 1: Подготовка решений распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
1: Подготовка решений распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
13.7: Разбавление раствора — Химия LibreTexts
Цели обучения
Нас часто интересует, сколько растворенного вещества растворено в заданном количестве раствора. Мы начнем обсуждение концентрации раствора с двух связанных и относительных терминов: разбавленный и концентрированный .
Эти два термина не предоставляют никакой количественной информации (фактических чисел), но они часто полезны для сравнения решений в более общем смысле. Эти термины также не говорят нам, является ли раствор насыщенным или ненасыщенным, является ли раствор «сильным» или «слабым». Эти два последних термина будут иметь особое значение, когда мы будем обсуждать кислоты и основания, поэтому будьте осторожны, чтобы не перепутать их.
Стандартные растворы
Часто необходимо иметь раствор с очень точно известной концентрацией. Растворы, содержащие точную массу растворенного вещества в точном объеме раствора, называются маточными (или стандартными) растворами . Для приготовления стандартного раствора следует использовать такое лабораторное оборудование, как мерная колба. Эти колбы имеют объем от 10 мл до 2000 мл и тщательно откалиброваны до единого объема. На узком стержне имеется калибровочная метка 9.0047 . Точную массу растворенного вещества растворяют в небольшом количестве растворителя и добавляют в колбу. Затем в колбу добавляют достаточное количество растворителя, пока уровень не достигнет калибровочной отметки.
Эти колбы имеют объем от 10 мл до 2000 мл и тщательно откалиброваны до единого объема. На узком стержне имеется калибровочная метка 9.0047 . Точную массу растворенного вещества растворяют в небольшом количестве растворителя и добавляют в колбу. Затем в колбу добавляют достаточное количество растворителя, пока уровень не достигнет калибровочной отметки.
Часто бывает удобно приготовить ряд растворов известных концентраций, сначала приготовив один исходный раствор , как описано в предыдущем разделе. Аликвоты (тщательно измеренные объемы) исходного раствора можно затем разбавить до любого желаемого объема. В других случаях может быть неудобно достаточно точно взвешивать небольшую массу образца для приготовления небольшого объема разбавленного раствора. Каждая из этих ситуаций требует разбавления раствора для получения желаемой концентрации.
Разведения стандартных (или стандартных) растворов
Представьте, что у нас есть раствор соленой воды определенной концентрации.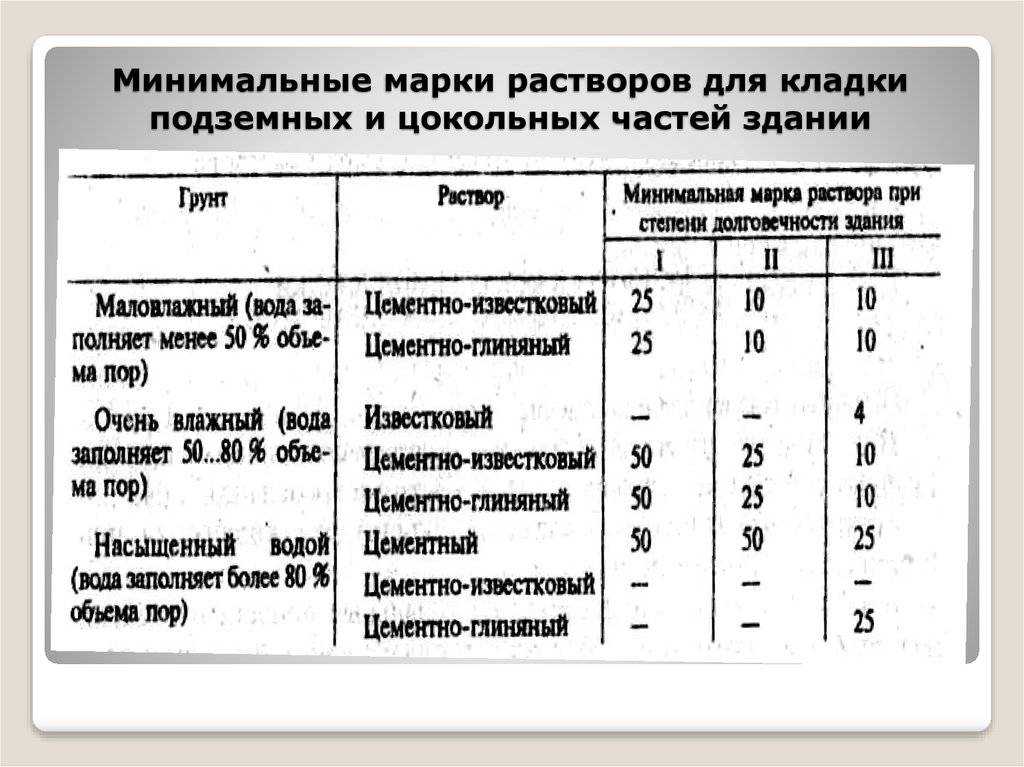 Это означает, что у нас есть определенное количество соли (определенная масса или определенное количество молей), растворенное в определенном объеме раствора. Далее мы разбавим этот раствор. Это делается добавлением большего количества воды, а не соли:
Это означает, что у нас есть определенное количество соли (определенная масса или определенное количество молей), растворенное в определенном объеме раствора. Далее мы разбавим этот раствор. Это делается добавлением большего количества воды, а не соли:
\(\rightarrow\)
До разбавления и после разбавления
Молярность раствора 1 равна
\[ M_1 = \dfrac{\text{моли }_1}{\text{литр}_1} \номер\]
, а молярность раствора 2 равна
\[ M_2 = \dfrac{\text{moles}_2}{\text{литр}_2} \nonumber \]
переставьте уравнения, чтобы найти моли:
\[ \text{моль}_1 = M_1 \text{литр}_1 \номер \]
и
\[ \text{моль}_2 = М_2 \text{литр}_2 \неномер \]
Что осталось прежним и что изменилось между двумя решениями? Добавляя больше воды, мы изменяли объем раствора. Это также изменило его концентрацию. Однако количество молей растворенного вещества не изменилось. Итак,
\[moles_1 = moles_2 \nonnumber \]
Следовательно
\[ \boxed{M_1V_1= M_2V_2 } \label{diluteEq} \]
где
3 \) — концентрации исходного и разбавленного растворов
Приготовление разбавлений является обычным делом в химической лаборатории и в других местах.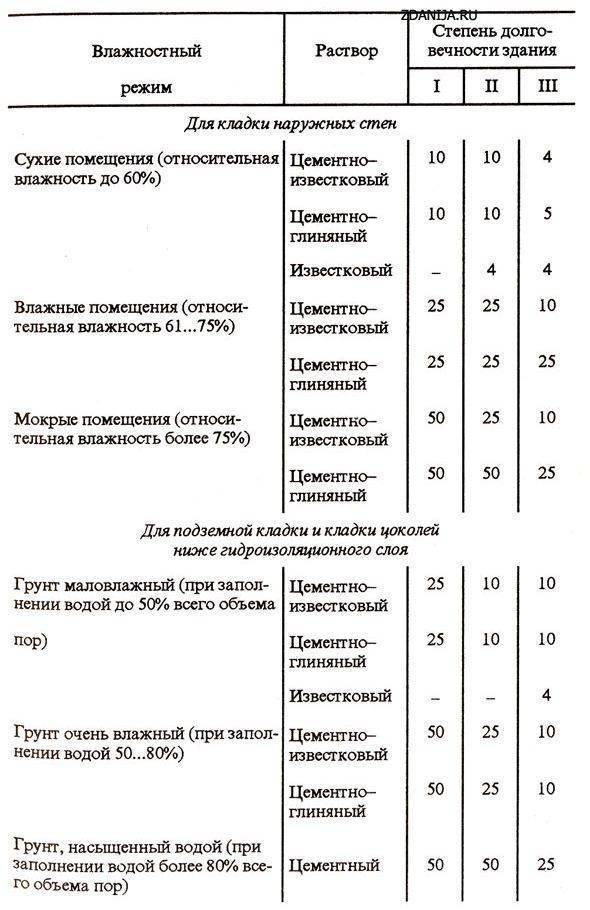 Как только вы поймете приведенную выше взаимосвязь, расчеты станут простыми.
Как только вы поймете приведенную выше взаимосвязь, расчеты станут простыми.
Предположим, что у вас есть \(100. \: \text{mL}\) раствора \(2.0 \: \text{M}\) \(\ce{HCl}\). Вы разбавляете раствор, добавляя достаточное количество воды, чтобы сделать объем раствора \(500. \: \text{мл}\). Новую молярность можно легко рассчитать, используя приведенное выше уравнение и решив \(M_2\).
\[M_2 = \dfrac{M_1 \times V_1}{V_2} = \dfrac{2.0 \: \text{M} \times 100. \: \text{mL}}{500. \: \text{мл}} = 0,40 \: \text{M} \: \ce{HCl} \nonumber \]
Раствор разбавлен на одну пятую, так как новый объем в пять раз превышает исходный. оригинальный объем. Следовательно, молярность составляет одну пятую от первоначального значения.
Другая распространенная проблема разбавления заключается в расчете количества высококонцентрированного раствора, необходимого для приготовления желаемого количества раствора меньшей концентрации. Высококонцентрированный раствор обычно называют исходным раствором.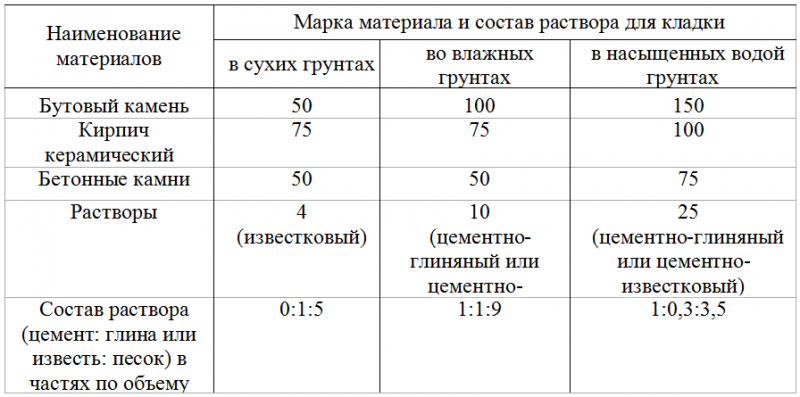
Пример \(\PageIndex{1}\): Разбавление азотной кислоты
Азотная кислота \(\left( \ce{HNO_3} \right)\) является сильной и агрессивной кислотой. При заказе в компании-поставщике химикатов его молярность составляет \(16 \: \text{M}\). Сколько исходного раствора азотной кислоты нужно использовать, чтобы получить \(8,00 \: \text{L}\) из \(0,50 \: \text{M}\) раствора?
Решение
| Действия по устранению неполадок | |
|---|---|
| Определите «данную» информацию и то, что проблема просит вас «найти». | Дано: M 1 , Запас \(\ce{HNO_3} = 16 \: \text{M}\) \(V_2 = 8.00 \: \text{L}\) \(М_2 = 0,50 \: \текст{М}\) Найти: Объем запаса \(\ce{HNO_3} \left( V_1 \right) = ? \: \text{L}\) |
Перечислите другие известные количества. | нет |
| Спланируйте задачу. | Сначала перестройте уравнение алгебраически, чтобы найти \(V_1\). \[V_1 = \dfrac{M_2 \times V_2}{M_1} \номер\] |
| Расчет и отмена единиц измерения. | Теперь подставьте известные величины в уравнение и решите. \[V_1 = \dfrac{0,50 \: \text{M} \times 8,00 \: \text{L}}{16 \: \text{M}} = 0,25 \: \text{L}\] |
| Подумайте о своем результате. | \( 0,25 \: \text{L} \: (250 \: \text{мл})\) исходного раствора \(\ce{HNO_3}\) необходимо разбавить водой до конечного объема \( 8.00 \: \text{L}\). Разведение производится в 32 раза, чтобы перейти от \(16 \: \text{M}\) до \(0,5 \: \text{M}\). |
Упражнение \(\PageIndex{1}\)
К 0,885 М раствору KBr с начальным объемом 76,5 мл добавляют воду до тех пор, пока его концентрация не станет 0,500 М. Каков новый объем раствора?
Ответ
135,4 мл
Обратите внимание, что расчетный объем будет иметь те же размеры, что и входной объем, и анализ размерностей говорит нам, что в этом случае нам не нужно преобразовывать в литры, так как L сокращается при делении М (моль/л) на М (моль/л).
Растворы для разбавления и смешивания
Как развести раствор от CarolinaBiological |
|---|
Эта страница под названием 13.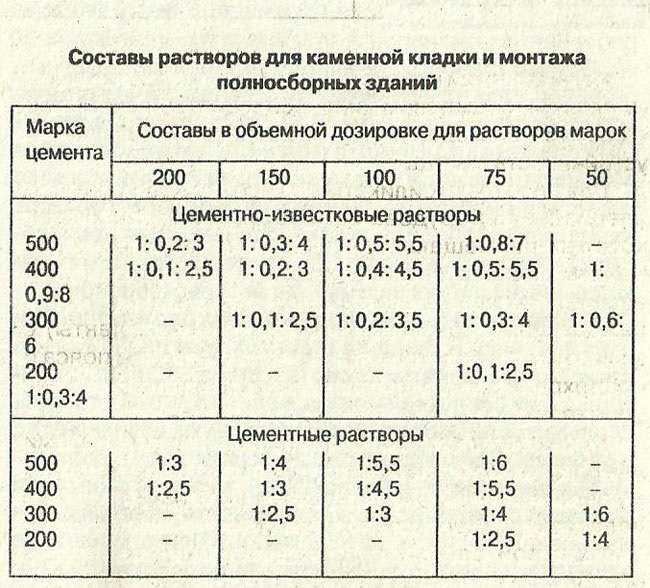

 Состав не должен приставать к ладоням. После просушки блинчиков оценивают результаты. Недостаток песка приведет к образованию трещин, а при его излишке глина раскрошится. Наилучшим считается тот вариант, при котором поверхность заготовки останется ровной и без трещин.
Состав не должен приставать к ладоням. После просушки блинчиков оценивают результаты. Недостаток песка приведет к образованию трещин, а при его излишке глина раскрошится. Наилучшим считается тот вариант, при котором поверхность заготовки останется ровной и без трещин. Достаточный уровень жирности будет при налипании на дерево 2 мм слоя раствора.
Достаточный уровень жирности будет при налипании на дерево 2 мм слоя раствора.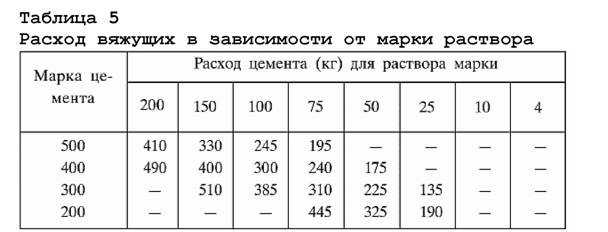

 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.

 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?