Содержание
Утилизация соли и соды в Украине
Утилизация соли препятствует возникновению вредных испарений, сохраняет флору, фауну и здоровье человека.
Соль представляет собой кристаллический осадок, который образуется в результате химической реакции кислот и щелочей с выделением воды. Традиционно выделяют средние, кислые, основные и комплексные соли в зависимости от особенностей молекулярного строения и способов получения.
Поваренная соль уже длительное время широко применяется человеком. Ее повсеместно используют в пищевой промышленности и кулинарии. Соль играет роль важной пищевой добавки и усилителя вкуса.
Отходы солей в промышленности
Помимо пищевой промышленности, отходы различных солей образуются и в ряде других случаев. Например, в результате гальванического производства, когда для нанесения защитного слоя металла применяются кислоты. Данная технология широко распространена при изготовлении оцинкованных или хромированных изделий. В процессе производства происходит образование осадка в виде остатков кислоты и металлических частиц.
В процессе производства происходит образование осадка в виде остатков кислоты и металлических частиц.
Другой источник образования солей – промышленные и лабораторные сточные воды, а также шлам очистных сооружений. Шлам – это осадок ила или пыли, который содержит опасные вещества (остается после фильтрации).
Также соли – побочный продукт добычи полезных ископаемых, таких как полиметаллические руды, нефть и природный газ.
Необходимость утилизации солей
Соли представляют серьезную опасность. Эти вещества отличаются высокой химической активностью. Оказавшись на открытом пространстве, они вступают в реакцию с воздухом. Испарения солей опасны для человека. Они могут спровоцировать развитие хронических заболеваний органов дыхательной системы. Складировать остатки солей на обычных свалках нельзя, так как они относятся ко II–IV классам опасных отходов.
Технология утилизации солей
Существует два способа утилизации солей:
- нейтрализация и дальнейшее захоронение;
- вторичная переработка.

Нейтрализация предполагает осаждение солей и их очистку. Захоронение сухого остатка выполняется на специально отведенных картах полигонов твердых бытовых отходов. При этом учитываются соответствующие нормы классификатора отходов. Полученный в процессе нейтрализации фильтрат поступает на дальнейшую очистку.
Вторичная переработка солей считается более выгодной, так как позволяет использовать отходы в качестве минеральных удобрений или строительного материала. К тому же, этот способ предпочтительнее с точки зрения рационального природопользования, ведь отходы не захораниваются на полигонах, а приносят пользу человеку без вреда для окружающей среды. Таким способом получают серобетон, когда используют модифицированную серу для капсулирования солей с образованием соответствующих гранул.
Утилизация соли сотрудниками «УтильВторПром»
Работы по утилизации соли проводятся в кратчайшие сроки с соблюдением всех экологических и законодательных норм. Заключаем договор по утилизации соли с предприятиями всех форм собственности. Для бюджетных организаций предусмотрена отсрочка платежа по утилизации соли.
Для бюджетных организаций предусмотрена отсрочка платежа по утилизации соли.
Утилизация соли осуществляется в городах: Киев, Винница, Днепр, Донецк, Житомир, Ивано-Франковск, Запорожье, Краматорск, Кривой Рог, Кропивницкий, Кременчуг, Львов, Луцк, Луганск, Мариуполь, Одесса, Николаев, Полтава, Ужгород, Ровно, Сумы, Тернополь, Харьков, Херсон, Хмельницкий, Чернигов, Черновцы, Черкассы, а также области и районные/административные центры Украины.
Стоимость утилизации соли напрямую зависит от ее места расположения/складирования (менеджером просчитываются затраты на транспортировку) и количества (чем больше общее количество – тем дешевле стоимость).
После оказания услуг по утилизации соли заказчику выдаются следующие документы: акт приема-передачи отходов с датой и количеством соли, переданной на утилизацию, бухгалтерский акт выполненных работ/оказанных услуг по утилизации соли, к которому также прилагаются соответствующие разрешительные документы нашей компании: лицензии, сертификаты, свидетельства, для предприятий плательщиков НДС в электронном виде регистрируется налоговая накладная.
Заказать услугу утилизации соли, соды, фруктов, овощей и других пищевых отходов, задать все интересующие вопросы можно по телефонам. Вы также можете оставить заявку на сайте, написать письмо на электронную почту [email protected].
Обратите внимание на эти страницы: Утилизация соды, Утилизация продуктов питания, Утилизация жира, Утилизация нефтепродуктов, Зачистка емкостей, резервуаров и отстойников
Заказать утилизацию отходов
В наличии
Утилизация соли и соды в Украине — УтильВторПром
Отзывы
-
Черная Мария27 мая 2020, 10:00
Для нас критично важным было наличие разрешительных документов. Обратились для утилизации отходов в эту компанию. Сотрудничество оставило только положительные впечатления Вот это я понимаю сервис. Спасибо. Рекомендуем.

Рейтинг:
-
Токарева Диана24 января 2018, 15:30
Остались довольны сотрудничеством. До этого долго искали надежного партнера. Разрешительные документы были главным критерием выбора подрядчика. Нам нужны документы для отчетности, поэтому обратились за утилизацией сюда. Успехов и процветания в вашем нелегком деле!
Рейтинг:
-
Лебедева Ясмина26 апреля 2017, 12:05
Здравствуйте. Нашли этот сайт через поиск. Непросто сделать выбор, но остановились именно на этой компании, у них есть лицензия на утилизацию многих видов отходов.
 Утилизация теперь поставлена на автомат. Можно заниматься своей работой не отвлекаясь на утилизацию. Только положительные впечатления от работы.
Утилизация теперь поставлена на автомат. Можно заниматься своей работой не отвлекаясь на утилизацию. Только положительные впечатления от работы.Рейтинг:
-
Смирнова Тамара01 июня 2022, 09:36
Сейчас тяжело найти надежных людей. Тяжело найти надежного партнера по утилизации Утилизация отходов в Украине вышла на новый уровень благодаря вашей работе. Спасибо за сотрудничество. Смело заказывайте утилизацию. Лучшей компании в Украине нет.
Рейтинг:
-
Софронов Никита26 сентября 2022, 10:00
Здравствуйте.
 Спасибо за сотрудничество. Тяжело найти надежного партнера по утилизации Качество услуг на высшем уровне. Профессиональный подход к утилизации отходов. Удобные условия работы. Рекомендуем.
Спасибо за сотрудничество. Тяжело найти надежного партнера по утилизации Качество услуг на высшем уровне. Профессиональный подход к утилизации отходов. Удобные условия работы. Рекомендуем.Рейтинг:
Добавить отзыв
Имя
Рейтинг
1
2
3
4
5
Текст отзыва
UtilVtorProm
Рейтинг
(4/5 Отзывов: 5
)
Виды соли, используемые при приготовлении пищи
Соль можно классифицировать, например, по способу производства и/или добычи, степени измельчения и очистки, содержанию натрия и примесей.
Хотя некоторые соли могут содержать больше разных минералов, чем обычная поваренная соль, их все же никак нельзя считать источниками соответствующих минералов (за искл. йодированной соли). При умеренном потреблении, независимо от вида соли, сопутствующие натрию минералы поступают в крайне малых количествах.
йодированной соли). При умеренном потреблении, независимо от вида соли, сопутствующие натрию минералы поступают в крайне малых количествах.
Никакая соль не может стать полноценным источником минеральных веществ. Это означает, что не нужно есть соль с целью получения минеральных веществ.
МОРСКАЯ СОЛЬ
Морскую соль получают путем выпаривания морской воды в специальных ваннах или прудах под действием солнца. Чистота морской соли зависит от состава и чистоты морской воды, из которой она производится. Кристаллы этой соли крупные, неровные. Помимо хлорида натрия, морская соль может содержать некоторое количество йода, кальция, магния и калия.
СОЛЬ ГРУБОГО ПОМОЛА, ИЛИ КАМЕННАЯ СОЛЬ
Грубую, или каменную соль по преимуществу добывают из подземных залежей. Каменная соль имеет грязно-серый цвет. В залежах каждого конкретного месторождения содержатся различные примеси, поэтому стабильной и/или равномерной чистоты каменной соли добиться почти невозможно.
ПОВАРЕННАЯ, ИЛИ СТОЛОВАЯ СОЛЬ
В случае поваренной соли основная часть воды удаляется из соляного раствора кипячением или выпариванием, после чего при помощи мощных центрифуг отделяется оставшаяся вода, чтобы в конце процесса влажность соли составляла около 3%. После дополнительной сушки получается равномерно чистая, мелкозернистая качественная поваренная соль.
ЙОДИРОВАННАЯ СОЛЬ
Йодированная соль обычно представляет собой столовую или минеральную соль с добавлением йода. Добавление йода не меняет вкуса соли. Йодированная соль – хороший способ получить недостающее количество необходимого организму йода.
ПАН-СОЛЬ
Пан-соль получают путем уменьшения содержания натрия в обычной столовой соли и добавлением 25–40% хлорида калия и 10% сульфата магния. Кроме того, в пан-соли есть аминокислота лизин, которая устраняет металлический привкус йода. В двух чайных ложках пан-соли содержится столько же натрия, сколько в одной чайной ложке поваренной соли. В действительности при употреблении пан-соли потребление натрия нередко не сокращается, поскольку ее добавляют в пищу в больших количествах, чтобы добиться привычного вкуса пищи.
В действительности при употреблении пан-соли потребление натрия нередко не сокращается, поскольку ее добавляют в пищу в больших количествах, чтобы добиться привычного вкуса пищи.
Источниками значимого количества минеральных веществ являются зерновые (особенно цельнозерновые продукты), картофель, фрукты и овощи, а также ягоды, молоко и молочные продукты, рыба, птица, яйца, мясо, добавляемые пищевые жиры, орехи, семена, плоды масличных культур, но не соль. Только йодированную соль можно считать полноценным источником йода.
Помимо обычной соли, в продаже можно найти разноцветные соли с разными названиями (например, Rose, Himaalaja, Hawai, Pärsia), состав и цвет которых зависят от места производства. Несмотря на то, что в их составе зачастую приведен целый список минералов, ни одна из этих солей не содержит ни один из минералов в таком количестве, чтобы оно покрыло значимую часть суточной потребности.
Кроме того, выпускается соль с различными вкусовыми нюансами. Это, например, ароматизированная, чесночная, копченая соль. Соль добавляется и во многие смеси пряностей (например, в перцовую смесь). Так что в случае смесей пряностей нужно обязательно читать маркировку, чтобы узнать, сколько соли они содержат.
Это, например, ароматизированная, чесночная, копченая соль. Соль добавляется и во многие смеси пряностей (например, в перцовую смесь). Так что в случае смесей пряностей нужно обязательно читать маркировку, чтобы узнать, сколько соли они содержат.
В производстве мяса часто используется соль с добавлением нитрита. Нитритная соль – соль высокой степени очистки, специально предназначенная для мясной промышленности. Эта соль придает мясу розовато-красный цвет и сдерживает развитие нежелательных микроорганизмов, продлевая тем самым срок годности продукта.
«Уличная химия» Для МЧС — Часть 3
Из элементов образуются две основные группы химических соединений: солей и несоленых. В каждой группе есть семейства соединений, каждое из которых связано с определенной опасностью. Понимая эти семейные отношения, аварийно-спасательные службы могут определять общую опасность материалов, определяя семейство, к которому принадлежит каждый из них.
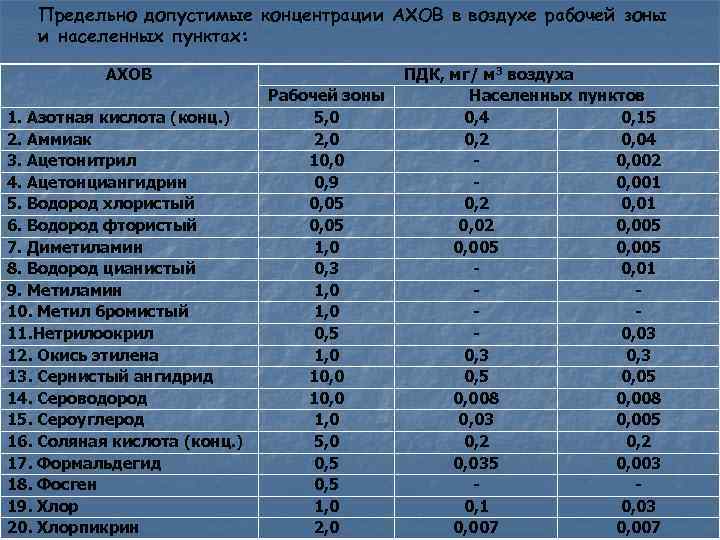
| Фото Роберта Берка Соли цианидов при контакте с кислотами выделяют цианистый водород, который используется в газовых камерах и может использоваться в химическом терроризме.  |
Эта «практическая информация» может помочь лицам, принимающим первые ответные меры, определить опасность конкретных материалов по прибытии на место происшествия, но она не устраняет необходимость дальнейшего исследования химических веществ до принятия мер по смягчению последствий.
Первая группа соединений известна как соли. Почти все знакомы по крайней мере с одной поваренной солью, которая есть почти в каждом доме и в каждом пищевом заведении, она известна химически как хлорид натрия и используется для приправы и консервирования пищевых продуктов.
Хлорид натрия встречается в природе в земной коре и океанах. Он состоит из хлора, который сам по себе очень токсичен и является окислителем, и металлического натрия, элемента, вступающего в реакцию с воздухом и водой. Когда эти элементы объединяются, образуется соединение, которое не реагирует с водой и не очень токсично. Молекулярная формула соединения хлорида натрия – NaCl. Хлорид натрия является основным источником производства хлора, поскольку хлор не существует в природе сам по себе.
Как правило, соли представляют собой водорастворимые твердые вещества; большинство из них не горят, но могут быть окислителями и поддерживать горение. Некоторые соли токсичны, а некоторые могут вступать в реакцию с водой. Правило обращения с солями: «Не трогать и держать их сухими». Опасности, присутствующие в данном семействе солей, кроме бинарных, являются результатом реакции с водой. Соли состоят из металла и неметалла. Например, снова взглянув на поваренную соль, хлор — это неметалл, а натрий — это металл. Этот процесс связывания, который создает соль, называется «ионной» связью.
| Фото Роберта Берка Некоторые соли, реагирующие с водой, при намокании выделяют токсичные пары, что требует от аварийно-спасательных служб защиты уровня А. |
Металлы обычно не соединяются друг с другом. Металлы, которые объединяются, плавятся и смешиваются вместе, образуя сплав. Например, медь и цинк расплавляют и смешивают вместе, чтобы получить латунь. Латунь не является элементом и не имеет молекулярной формулы. Настоящая химическая связь отсутствует, это просто смесь цинка и меди.
Например, медь и цинк расплавляют и смешивают вместе, чтобы получить латунь. Латунь не является элементом и не имеет молекулярной формулы. Настоящая химическая связь отсутствует, это просто смесь цинка и меди.
Вторая основная группа соединений — это неметаллические элементы, которые можно назвать несолями. Несоли – это твердые тела, жидкости и газы. Многие несоленые соединения легко воспламеняются. Например, неметаллический углерод соединяется с неметаллическим водородом с образованием углеводородного соединения. Типичным углеводородом является метан с молекулярной формулой CH 4 . Метан также известен как природный газ и очень легко воспламеняется. Углеводороды и другие несоленые семейства и соединения будут обсуждаться в следующей колонке.
Точно так же, как периодическая таблица элементов организована в семейства элементов, соединения также могут быть помещены в семейства. С семейством материалов связаны особые опасности. Если вы можете определить семейство, к которому принадлежит материал, по его названию или формуле, вы должны быть в состоянии определить опасность, даже если вы ничего не знаете о конкретном химическом веществе.
Соли представляют особую опасность в зависимости от того, к какому семейству солей они принадлежат. Семейства солей можно разделить на группы: бинарные соли и бинарные оксиды или оксиды металлов.
Бинарные соли
Первое семейство солевых соединений, которое мы обсудим, — это бинарные соли. Бинарные (то есть две) соли состоят из двух элементов: металла и любого неметалла, кроме кислорода. Их химические названия заканчиваются на «язь», например, хлорид калия. Когда встречается соединение с металлом, оканчивающимся на «язь», респонденты знают, что его нужно искать, чтобы определить реальную опасность.
Бинарные соли представляют собой один тип семейства, к которому не применяется семейный эффект обычных опасностей, за исключением нескольких соединений. Бинарные соли как группа имеют различную опасность. Они могут реагировать с водой и быть токсичными, а при контакте с водой могут образовывать коррозионную жидкость и выделять тепло. (Это также называется экзотермической реакцией. )
)
Опасность отдельной бинарной соли не может быть определена семейством, кроме четырех типов бинарных солей, поэтому их необходимо исследовать в справочных материалах. Эта различная опасность относится ко всем бинарным солям, кроме нитридов, карбидов, гидридов и фосфидов. Один из способов запомнить эти четыре бинарные соли — использовать первые буквы названий элементов для образования инициалов NCHP, которые можно запомнить как «Дорожный патруль Северной Каролины». Это соединения, в которых металл связан с неметаллическим азотом, углеродом, фосфором или водородом.
Все эти соединения реагируют с водой и представляют особую опасность, связанную с ними при контакте с водой: нитриды выделяют аммиак, карбиды выделяют ацетилен, фосфиды выделяют газообразный фосфин, а гидриды образуют газообразный водород. Каждый из этих газов, образующихся в результате реакции с водой, имеет свою особую опасность:
- Фосфин — бесцветный газ с неприятным чесночным запахом.
 Он спонтанно воспламеняется, токсичен при вдыхании и является сильным раздражителем. Фосфин имеет пороговое предельное значение (TLV) 0,3 частей на миллион в воздухе.
Он спонтанно воспламеняется, токсичен при вдыхании и является сильным раздражителем. Фосфин имеет пороговое предельное значение (TLV) 0,3 частей на миллион в воздухе. - Аммиак представляет собой бесцветный газ с очень резким раздражающим запахом. Хотя Министерство транспорта США (DOT) не считает его легковоспламеняющимся газом, он может воспламеняться при определенных условиях, особенно внутри зданий и в замкнутых пространствах. Кроме того, аммиак токсичен при вдыхании с TLV 25 частей на миллион.
- Водород — это легковоспламеняющийся газ, горящий почти невидимым пламенем и практически не образующий дыма. Водород имеет широкий диапазон воспламеняемости от 4% до 75%.
- Газ ацетилен легко воспламеняется; он имеет диапазон воспламеняемости от 2,5% до 80%.
Фото Роберта Берка
Хлор производится из соли хлорида натрия.В дополнение к газам, выделяющимся при контакте этих солей с водой, образуется коррозионная основа.
 Коррозионной основой будет гидроксид металла, присоединенный к неметаллу. Например, карбид кальция при контакте с водой будет выделять газообразный ацетилен и коррозионно-активную жидкую гидроокись кальция. Ацетиленовый газ является распространенным газом для сварки и резки. Он настолько нестабилен, что его не отгружают в вагонах-цистернах или грузовиках. Вместо этого карбид кальция отправляется на предприятие, где производится ацетилен, который помещается в знакомые небольшие сварочные резервуары. Ацетилен не может находиться под давлением, поэтому для стабилизации его растворяют в ацетоне в баке.
Коррозионной основой будет гидроксид металла, присоединенный к неметаллу. Например, карбид кальция при контакте с водой будет выделять газообразный ацетилен и коррозионно-активную жидкую гидроокись кальция. Ацетиленовый газ является распространенным газом для сварки и резки. Он настолько нестабилен, что его не отгружают в вагонах-цистернах или грузовиках. Вместо этого карбид кальция отправляется на предприятие, где производится ацетилен, который помещается в знакомые небольшие сварочные резервуары. Ацетилен не может находиться под давлением, поэтому для стабилизации его растворяют в ацетоне в баке.Гидроксид кальция является сильным коррозионно-активным основанием с рН 12,4. Это раздражитель кожи и опасность вдыхания. TLV составляет 5 мг/м3 воздуха. Когда ликвидаторы сталкиваются с карбидами и другими солями, реагирующими с водой, в разливе, они должны быть осторожны и не применять воду без крайней необходимости. Если прогнозируется дождь, газообразный ацетилен будет образовываться, когда дождь контактирует с карбидом кальция при разливе.
 Необходимо позаботиться о покрытии материала, чтобы он оставался сухим.
Необходимо позаботиться о покрытии материала, чтобы он оставался сухим.Что касается оставшихся бинарных солей, спасатели должны найти их, чтобы определить их опасность. Например, когда металлический литий соединяется с хлором, в полученном соединении есть металл и неметалл, кроме кислорода, и название оканчивается на «ид». Следовательно, он подходит под определение бинарной соли. Если исследовать хлорид лития в справочных источниках, оказывается, что он растворим в воде. Не реагирует с водой; на самом деле хлорид лития не представляет значительной опасности при разливе. DOT не включает хлорид лития в свои таблицы опасных материалов.
В следующем примере сочетаются металлический кальций и неметаллический фосфор, что приводит к соединению фосфида кальция. Это опасная пожароопасность. Название соединения заканчивается на «язь»; следовательно, это также бинарная соль.
Бинарные соли имеют разную опасность. Обратите внимание на следующие примеры:
- Фторид лития сильно раздражает глаза и кожу.

- Бромид калия токсичен при проглатывании и вдыхании.
- Натрия хлорид — соль поваренная; вызывает медицинскую озабоченность при приеме внутрь в избытке, но, безусловно, не представляет существенной опасности для аварийно-спасательных служб. Однако, если во время аварии на поле фермера попадет хлорид натрия, фермер может не иметь возможности выращивать урожай на этом поле в течение многих лет!
Бинарные оксиды или оксиды металлов
Следующее семейство солевых соединений известно как бинарные или оксиды металлов. Каждый состоит из двух элементов: металла и неметалла, но неметаллом может быть только кислород. Они заканчиваются на «оксид», например, оксид алюминия. Как группа, они реагируют с водой и при контакте с водой почти всегда выделяют тепло и образуют коррозионную жидкость. Однако они не выделяют кислород, потому что нет избытка кислорода.
Пероксиды представляют собой солевые соединения, каждое из которых состоит из пероксидного радикала металла и неметалла «O 2 — 2 ».
 Приставка «per» перед названием соединения или элемента означает, что материал «нагружен» атомами определенного элемента. В случае перекисей они загружены кислородом.
Приставка «per» перед названием соединения или элемента означает, что материал «нагружен» атомами определенного элемента. В случае перекисей они загружены кислородом.При контакте перекиси с водой выделяется тепло, образуется коррозионная жидкость и выделяется кислород. Это делает пероксиды особенно опасными в присутствии огня. Пероксиды выделяют кислород, потому что, в отличие от оксидных солей, присутствует избыток кислорода. Тепла, выделяющегося при реакции с водой, может быть достаточно для воспламенения близлежащих горючих материалов. Присутствующий избыток кислорода может ускорить горение. При контакте с водой пероксид натрия представляет опасность пожара и взрыва, а также является сильным окислителем.
Каждая из гидроксидных солей состоит из радикала гидроксида металла и неметалла -OH- 1 . Название заканчивается словом «гидроксид». Они реагируют с водой и при контакте с водой выделяют тепло и образуют коррозионную жидкость. Если металлический кальций соединить с радикалом гидроксида, в результате получится гидроксид кальция, гидроксидная соль.

Оксисоли представляют собой еще одно семейство солевых соединений. Они сделаны из металла и «окси» радикала. Их имена заканчиваются на «ate» или «ite» и могут иметь префиксы «per» или «hypo». Как правило, они не реагируют с водой; они растворяются в воде. Некоторые из «гипоитов» технически реагируют с водой с выделением хлора, но реакции мягкие. Оксисоли представляют собой семейство окислителей, что означает, что они будут выделять кислород, который ускорит горение, если присутствует огонь.
Другая опасность возникает, когда оксисоль растворяется в воде, и вода впитывается в другой материал, например, в упаковку или пожарные стрелочные переводы. Вода испарится, оставив оксисоль. Если материал затем подвергается воздействию тепла или огня, он очень быстро сгорает из-за оксисолей в материале, ускоряющих горение.
С этой группой будут представлены девять оксисолевых радикалов. Это не единственные «окси» радикалы, но выбранные считаются наиболее важными для аварийно-спасательного персонала.
 «Окси» радикалы: FO 3 Fluotoart, CLO 3 Хлорат, BRO 3 Бромат, IO 3 йодат, № 3 Нитрат, MNO 3 Manganate, CO 3 Картанат. фосфат. Все перечисленные радикалы считаются находящимися в основном состоянии. (Основное состояние связано с количеством атомов кислорода, присутствующих в радикале. Основное состояние — это «нормальное» число атомов кислорода, присутствующих в этом оксирадикале.)
«Окси» радикалы: FO 3 Fluotoart, CLO 3 Хлорат, BRO 3 Бромат, IO 3 йодат, № 3 Нитрат, MNO 3 Manganate, CO 3 Картанат. фосфат. Все перечисленные радикалы считаются находящимися в основном состоянии. (Основное состояние связано с количеством атомов кислорода, присутствующих в радикале. Основное состояние — это «нормальное» число атомов кислорода, присутствующих в этом оксирадикале.)Когда металл добавляется к любому оксирадикалу в основном состоянии, соединение оканчивается на «ate», например, фосфат натрия. Например, когда металлический калий соединяется с оксирадикальным карбонатом, в результате получается карбонат калия. Соединение не имеет префикса перед оксирадикалом и заканчивается на «ат»; следовательно, это основное состояние соединения.
Окси-радикалы могут быть найдены с различным числом атомов кислорода. Атомов кислорода может быть больше, чем в основном состоянии, или меньше атомов, чем в основном состоянии.
 При названии соединений с дополнительным атомом кислорода приставка «пер» используется для обозначения избытка кислорода по сравнению с основным состоянием, но окончание по-прежнему «ели». Примером может служить персульфат натрия. Когда металлический калий соединяется с перхлоратом оксирадикала, получается соединение перхлората калия. Уровень кислорода на единицу выше основного состояния. Перхлорат калия представляет опасность возгорания при контакте с органическими материалами, сильный окислитель и сильный раздражитель.
При названии соединений с дополнительным атомом кислорода приставка «пер» используется для обозначения избытка кислорода по сравнению с основным состоянием, но окончание по-прежнему «ели». Примером может служить персульфат натрия. Когда металлический калий соединяется с перхлоратом оксирадикала, получается соединение перхлората калия. Уровень кислорода на единицу выше основного состояния. Перхлорат калия представляет опасность возгорания при контакте с органическими материалами, сильный окислитель и сильный раздражитель.Когда количество атомов кислорода на один меньше, чем в основном состоянии оксирадикала, окончание названия оксирадикала будет «ite». Примером может служить сульфит магния. Если металлический натрий соединить с оксирадикальным фосфитом, то кислорода будет на один меньше, чем в основном состоянии. Помимо того, что он является окислителем, фосфит натрия также является противоядием при отравлении хлоридом ртути.
Фото Роберта Берка
Железнодорожная цистерна, перевозящая раствор хлората натрия, оксисоль. Если этим раствором пропитать снаряжение пожарного, вода испарится, а на нем останутся оксисоли. Если затем материал подвергнуть воздействию тепла или огня, он сгорит очень быстро, потому что оксисоль ускорит горение.
Если этим раствором пропитать снаряжение пожарного, вода испарится, а на нем останутся оксисоли. Если затем материал подвергнуть воздействию тепла или огня, он сгорит очень быстро, потому что оксисоль ускорит горение. Наконец, оксирадикал может иметь на два атома кислорода меньше, чем в основном состоянии. Название оксирадикала теперь будет иметь префикс «гипо» и заканчиваться на «ите». Примером может служить гипофосфит алюминия. Или, если металлический кальций соединить с оксирадикальным гипохлоритом, полученное соединение будет гипохлоритом кальция, обычным хлорирующим средством для плавательных бассейнов. Гипохлорит кальция является окислителем и представляет опасность возгорания при контакте с органическими материалами.
Цианидные соли состоят из металла и цианидного радикала «CN». Название полученного соединения оканчивается словом «цианид». Примером может служить цианистый калий. Соли цианидов представляют собой токсичные материалы, которые растворяются в воде с образованием раствора цианистого водорода.
 Образуются ионы гидроксида, которые превращают раствор в щелочь, вызывающую коррозию.
Образуются ионы гидроксида, которые превращают раствор в щелочь, вызывающую коррозию.Соли цианидов реагируют с кислотами с образованием циановодородного газа с миндальным запахом. Это цианистый водород, который используется в газовых камерах. Цианистый водород также известен как отравляющее вещество крови, которое потенциально может быть использовано при химической террористической атаке. Цианиды являются смертельными ядами и могут быть найдены в виде солей или растворов и могут выделять токсичный газ при нагревании.
Когда ион цианида попадает в организм, он образует комплексный ион с ионом меди, находящимся в клетках организма. Эти ионы меди необходимы для фермента, который жизненно важен для того, чтобы клетка могла использовать кислород из крови. Этот фермент дезактивируется связыванием иона цианида и ионов меди.
Темы химии, которые будут обсуждаться в следующей статье, будут включать несоленые соединения, семейства углеводородов и производных углеводородов, а также опасности.

Роберт Берк, пишущий редактор Firehouse®, является специалистом по противопожарной защите и опасным материалам в Университете Мэриленда и работал в группах реагирования на опасные вещества штата и округа. Берк имеет 16-летний опыт работы в профессиональных и волонтерских пожарных частях. Он имеет степень бакалавра в области пожарной науки и является адъюнкт-инструктором в Национальной пожарной академии и Мэрилендском пожарно-спасательном институте. Книга Берка «Химия опасных материалов для аварийно-спасательных служб» была опубликована 19 января.97. С ним можно связаться в Интернете по адресу [email protected]. - Фторид лития сильно раздражает глаза и кожу.
Соль | Химия, история, возникновение, производство, использование и факты
соль
Просмотреть все материалы
- Связанные темы:
- поваренная соль
неорганическое соединение
открытая кристаллизация
добыча соли
Брикеттаж
См. все связанные материалы →
соль (NaCl) , хлорид натрия , минеральное вещество, имеющее большое значение для здоровья человека и животных, а также для промышленности. Минеральную форму галита, или каменную соль, иногда называют поваренной солью, чтобы отличить ее от класса химических соединений, называемых солями.
Минеральную форму галита, или каменную соль, иногда называют поваренной солью, чтобы отличить ее от класса химических соединений, называемых солями.
Свойства поваренной соли показаны в таблице Щелкните здесь, чтобы увидеть полноразмерную табличку. Соль необходима для здоровья как людей, так и животных. Поваренная соль, повсеместно используемая в качестве приправы, имеет мелкозернистую структуру и высокую чистоту. Чтобы это гигроскопичное (т. е. притягивающее воду) вещество оставалось сыпучим при контакте с атмосферой, в него добавляют небольшое количество алюмосиликата натрия, трикальцийфосфата или силиката магния. Йодированная соль, то есть соль, в которую добавлено небольшое количество йодида калия, широко используется в районах, где в рационе не хватает йода, дефицит, который может вызвать опухоль щитовидной железы, обычно называемую зобом. Домашнему скоту также требуется соль; он часто доступен в виде сплошных блоков.
В мясной, колбасной, рыбокопченой и пищевой промышленности соль используется в качестве консерванта или приправы, или того и другого. Он используется для лечения и сохранения шкур и в качестве рассола для охлаждения.
Он используется для лечения и сохранения шкур и в качестве рассола для охлаждения.
В химической промышленности соль требуется при производстве бикарбоната натрия (пищевой соды), гидроксида натрия (едкого натра), соляной кислоты, хлора и многих других химических веществ. Соль применяется также в производстве мыла, глазури, фарфоровой эмали, входит в металлургические процессы в виде флюса (вещества, способствующего плавлению металлов).
Узнайте, как соль помогает растопить лед на дорогах зимой
Посмотреть все видео к этой статье
При нанесении на снег или лед соль снижает температуру плавления смеси. Таким образом, в северном климате большие количества используются для очистки транспортных магистралей от скопившегося снега и льда. Соль используется в оборудовании для умягчения воды, которое удаляет из воды соединения кальция и магния.
В некоторых частях Западного полушария и в Индии употребление соли было введено европейцами, но в некоторых частях Центральной Африки это по-прежнему роскошь, доступная только богатым. Там, где люди питаются в основном молоком и сырым или жареным мясом (чтобы не терялись его естественные соли), добавки хлорида натрия не нужны; кочевники со своими стадами овец или стадами крупного рогатого скота, например, никогда не едят соль с пищей. С другой стороны, люди, которые живут в основном на злаках, овощах или вареном мясе, нуждаются в добавках соли.
Там, где люди питаются в основном молоком и сырым или жареным мясом (чтобы не терялись его естественные соли), добавки хлорида натрия не нужны; кочевники со своими стадами овец или стадами крупного рогатого скота, например, никогда не едят соль с пищей. С другой стороны, люди, которые живут в основном на злаках, овощах или вареном мясе, нуждаются в добавках соли.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Привычное использование соли тесно связано с переходом от кочевого образа жизни к земледельческому, этапом цивилизации, который глубоко повлиял на ритуалы и культы почти всех древних народов. Богов почитали как дарителей добрых плодов земли, а соль обычно включали в жертвоприношения, полностью или частично состоящие из злаковых элементов. Такие подношения были распространены у греков и римлян, а также у ряда семитских народов.
Заветы обычно заключались во время жертвенной трапезы, в которой соль была необходимым элементом. Сохраняющие свойства соли сделали ее особенно подходящим символом прочного договора, скрепив его обязательством верности. Таким образом, слово и соль приобрело коннотации высокого уважения и чести в древних и современных языках. Примеры включают арабское заявление «Соль между нами», еврейское выражение «есть соль дворцовую» и современную персидскую фразу 9.0212 намак харам , «неверный соли» (т. е. неверный или неблагодарный). В английском языке термин «соль земли» описывает человека, пользующегося большим уважением.
Сохраняющие свойства соли сделали ее особенно подходящим символом прочного договора, скрепив его обязательством верности. Таким образом, слово и соль приобрело коннотации высокого уважения и чести в древних и современных языках. Примеры включают арабское заявление «Соль между нами», еврейское выражение «есть соль дворцовую» и современную персидскую фразу 9.0212 намак харам , «неверный соли» (т. е. неверный или неблагодарный). В английском языке термин «соль земли» описывает человека, пользующегося большим уважением.
Соль вносит большой вклад в наши знания о древних торговых путях. Одной из старейших дорог Италии является Виа Салария (Соляной путь), по которой римская соль из Остии доставлялась в другие части Италии. Геродот рассказывает о караванном пути, который соединял соляные оазисы Ливийской пустыни. Древняя торговля между Эгейским и Черноморским побережьем юга России в значительной степени зависела от соляных промыслов (прудов для выпаривания морской воды для получения соли) в устье Днепра и от соленой рыбы, привозимой из этого района.



 Утилизация теперь поставлена на автомат. Можно заниматься своей работой не отвлекаясь на утилизацию. Только положительные впечатления от работы.
Утилизация теперь поставлена на автомат. Можно заниматься своей работой не отвлекаясь на утилизацию. Только положительные впечатления от работы. Спасибо за сотрудничество. Тяжело найти надежного партнера по утилизации Качество услуг на высшем уровне. Профессиональный подход к утилизации отходов. Удобные условия работы. Рекомендуем.
Спасибо за сотрудничество. Тяжело найти надежного партнера по утилизации Качество услуг на высшем уровне. Профессиональный подход к утилизации отходов. Удобные условия работы. Рекомендуем. Он спонтанно воспламеняется, токсичен при вдыхании и является сильным раздражителем. Фосфин имеет пороговое предельное значение (TLV) 0,3 частей на миллион в воздухе.
Он спонтанно воспламеняется, токсичен при вдыхании и является сильным раздражителем. Фосфин имеет пороговое предельное значение (TLV) 0,3 частей на миллион в воздухе. Коррозионной основой будет гидроксид металла, присоединенный к неметаллу. Например, карбид кальция при контакте с водой будет выделять газообразный ацетилен и коррозионно-активную жидкую гидроокись кальция. Ацетиленовый газ является распространенным газом для сварки и резки. Он настолько нестабилен, что его не отгружают в вагонах-цистернах или грузовиках. Вместо этого карбид кальция отправляется на предприятие, где производится ацетилен, который помещается в знакомые небольшие сварочные резервуары. Ацетилен не может находиться под давлением, поэтому для стабилизации его растворяют в ацетоне в баке.
Коррозионной основой будет гидроксид металла, присоединенный к неметаллу. Например, карбид кальция при контакте с водой будет выделять газообразный ацетилен и коррозионно-активную жидкую гидроокись кальция. Ацетиленовый газ является распространенным газом для сварки и резки. Он настолько нестабилен, что его не отгружают в вагонах-цистернах или грузовиках. Вместо этого карбид кальция отправляется на предприятие, где производится ацетилен, который помещается в знакомые небольшие сварочные резервуары. Ацетилен не может находиться под давлением, поэтому для стабилизации его растворяют в ацетоне в баке. Необходимо позаботиться о покрытии материала, чтобы он оставался сухим.
Необходимо позаботиться о покрытии материала, чтобы он оставался сухим.
 Приставка «per» перед названием соединения или элемента означает, что материал «нагружен» атомами определенного элемента. В случае перекисей они загружены кислородом.
Приставка «per» перед названием соединения или элемента означает, что материал «нагружен» атомами определенного элемента. В случае перекисей они загружены кислородом.
 «Окси» радикалы: FO 3 Fluotoart, CLO 3 Хлорат, BRO 3 Бромат, IO 3 йодат, № 3 Нитрат, MNO 3 Manganate, CO 3 Картанат. фосфат. Все перечисленные радикалы считаются находящимися в основном состоянии. (Основное состояние связано с количеством атомов кислорода, присутствующих в радикале. Основное состояние — это «нормальное» число атомов кислорода, присутствующих в этом оксирадикале.)
«Окси» радикалы: FO 3 Fluotoart, CLO 3 Хлорат, BRO 3 Бромат, IO 3 йодат, № 3 Нитрат, MNO 3 Manganate, CO 3 Картанат. фосфат. Все перечисленные радикалы считаются находящимися в основном состоянии. (Основное состояние связано с количеством атомов кислорода, присутствующих в радикале. Основное состояние — это «нормальное» число атомов кислорода, присутствующих в этом оксирадикале.)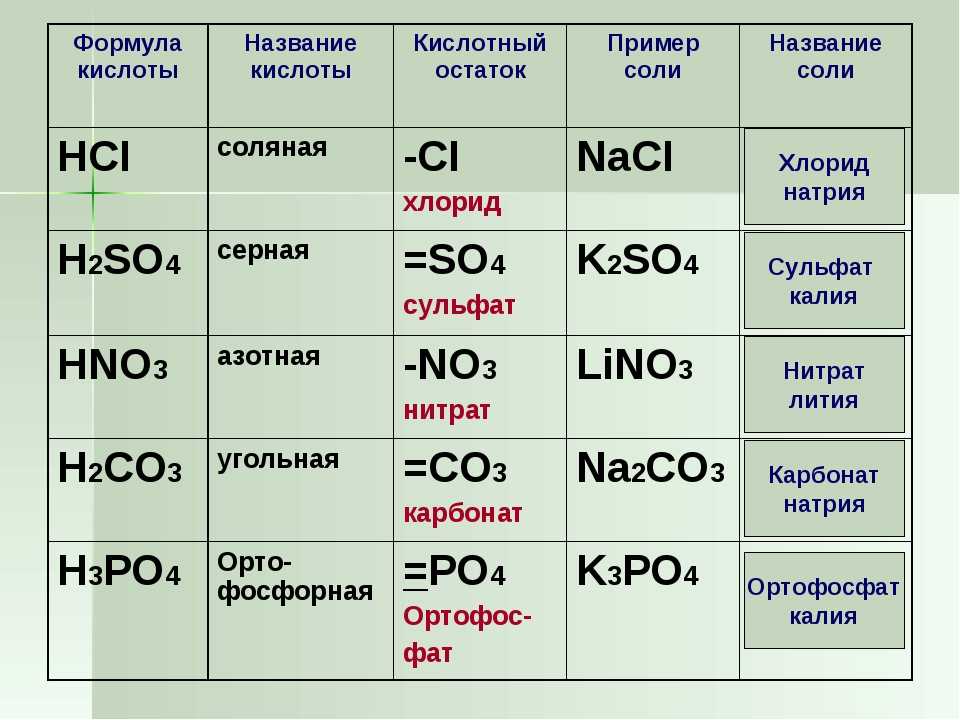 При названии соединений с дополнительным атомом кислорода приставка «пер» используется для обозначения избытка кислорода по сравнению с основным состоянием, но окончание по-прежнему «ели». Примером может служить персульфат натрия. Когда металлический калий соединяется с перхлоратом оксирадикала, получается соединение перхлората калия. Уровень кислорода на единицу выше основного состояния. Перхлорат калия представляет опасность возгорания при контакте с органическими материалами, сильный окислитель и сильный раздражитель.
При названии соединений с дополнительным атомом кислорода приставка «пер» используется для обозначения избытка кислорода по сравнению с основным состоянием, но окончание по-прежнему «ели». Примером может служить персульфат натрия. Когда металлический калий соединяется с перхлоратом оксирадикала, получается соединение перхлората калия. Уровень кислорода на единицу выше основного состояния. Перхлорат калия представляет опасность возгорания при контакте с органическими материалами, сильный окислитель и сильный раздражитель. Если этим раствором пропитать снаряжение пожарного, вода испарится, а на нем останутся оксисоли. Если затем материал подвергнуть воздействию тепла или огня, он сгорит очень быстро, потому что оксисоль ускорит горение.
Если этим раствором пропитать снаряжение пожарного, вода испарится, а на нем останутся оксисоли. Если затем материал подвергнуть воздействию тепла или огня, он сгорит очень быстро, потому что оксисоль ускорит горение. 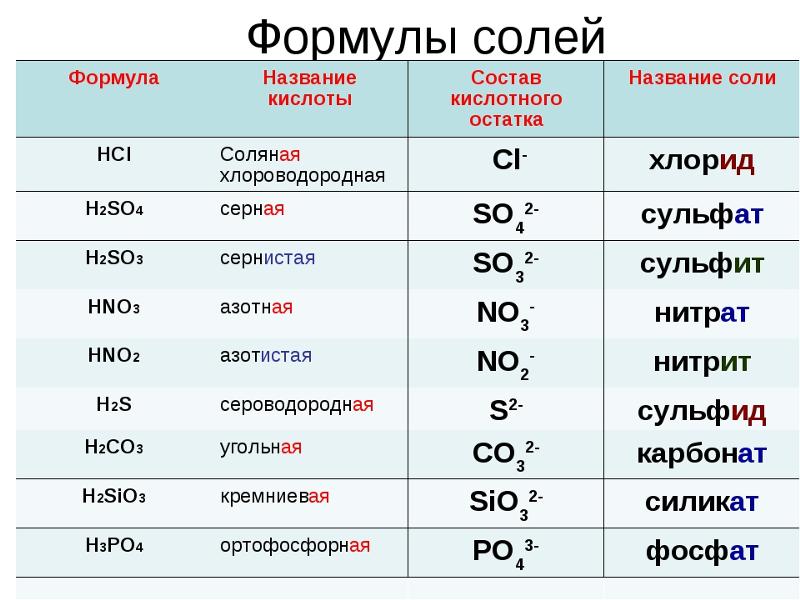 Образуются ионы гидроксида, которые превращают раствор в щелочь, вызывающую коррозию.
Образуются ионы гидроксида, которые превращают раствор в щелочь, вызывающую коррозию.