Способ получения полисиликата лития. Полисиликат лития
Полисиликат - литий - Большая Энциклопедия Нефти и Газа, статья, страница 1
Полисиликат - литий
Cтраница 1
Полисиликаты лития используются наиболее широко в качестве связующего для антикоррозионных покрытий на основе цинка. Такие покрытия обладают высокой устойчивостью в морской воде, в различных грунтовых водах. Существует много вариантов цинковых антикоррозионных покрытий с использованием силикатов или полисиликатов лития, отличающихся различными добавками, модифицирующими то или иное свойство покрытия. Например, тонкие пленки силикатов лития служат для защиты оптических стекол. [1]
Другим применением полисиликата лития является уменьшение липкости кухонной посуды [121], что обеспечивается за счет способности полисиликата лития образовывать промежуточное соединение, связывающее между собой фтор-углеводородное полимерное покрытие и металл. [2]
Гидроокись лития 1 также силикат или полисиликат лития полезны как добав, натриевым или калиевым силикатным системам, модифицируя свойства. Одним из таких свойств является устойчивость поли-силикатной системы, которую часто требуется менять в ту или иную сторону в различных технологиях. Введение катионов тетраэтиламмония ( ТЭА) резко увеличивает устойчивость полисиликатной системы по отношению к гелеобразо-ванию. В малых дозах бромиды и гидроксиды ТЭА малоразличимы по эффекту действия. В больших дозах они перестают быть эквивалентными, так как бромиды значительно увеличивают ионную силу раствора и тем понижают стабилизирующее действие катионов. Гидроксиды четвертичного аммония в отличие от бромидов усваиваются полисиликатной системой, несколько понижая ее общий модуль, но не влияя на стабилизирующий эффект. Среди органических катионов тетраэтиламмоний не является наилучшим по своему действию. Дилер приводит ряд других, более сложных катионов, которые можно вводить в значительно меньших пропорциях, доводя отношение SiCb / ( R4N) 2О почти до 103, для достижения того же результата. [4]
Поскольку силикаты лития резко отличны по своему поведению от силикатов натрия и калия, то полисиликаты лития рассматриваются в настоящей главе отдельно. [5]
Вероятно, только с 1950 г. был признан тот факт, что устойчивые растворы силикатов и полисиликатов лития можно готовить с любым желаемым отношением Si02: Li20 и что такие растворы обладают полезными свойствами. [6]
Другим применением полисиликата лития является уменьшение липкости кухонной посуды [121], что обеспечивается за счет способности полисиликата лития образовывать промежуточное соединение, связывающее между собой фтор-углеводородное полимерное покрытие и металл. [7]
Прочная многослойная гидратная оболочка катиона лития, возможно, обусловливает устойчивость весьма концентрированных и высокомодульных растворов силиката и полисиликата лития при хранении, в отличие от калиевых и особенно натриевых растворов, которые при модулях выше 4 обладают малой жизнеспособностью и склонны к самопроизвольному гелеобразованию. [8]
Помимо высокой устойчивости, литиевые растворы гораздо более совместимы с водорастворимыми органическими веществами, чем натриевые или калиевые. Дилером исследованы состарившиеся в течение недели системы водных полисиликатов лития, получен-н Ые смешением растворов низкомолекулярной кислоты и гидроокиси лития. [10]
С этой целью навеску анализируемого раствора ( для золей - 2 - 5 г, для полисиликатов лития - 0 5 f 0 г, для жидких стекол - 0 2 - 0 5 г), взятую в стеклянном стаканчике на 20 мл, быстро разбавляли до 20 мл ( до концентрации SiO2l %), переносили в мерную колбу и быстро подкисляли 1 5 н h3SO4 до рН 1 7 - 2 0, затем разбавляли водой до метки. Вся операция подготовки пробы, включая разбавление, подкисление, доведение водой до метки в мерной колбе, контроль рН - раствора. [11]
Так же как и при растворении золей в калиевой щелочи ( см. рис. 35), содержание a - SiCb в первый период оказывается значительно выше, чем в последующем, и в течение 100 сут наблюдаются затухающие колебания a - формы кремнезема. Видимо, растворение золя в щелочи идет через образование мономеров в растворе, которые со временем полимеризуются, но, в отличие от золя, при комнатной температуре сохраняют гидратированную форму и легко титруются с NaF. Все синтезированные растворы полисиликатов лития сохраняются больше года. Таким образом, растворы полисиликатов лития, приготовленные из высокополимерных форм кремнезема, при комнатной температуре отличаются от растворов, приготовленных из малополимерной кремневой кислоты, наличием золевой составляющей, которая длительно сохраняется в растворе. [13]
При нагревании такого разбавленного раствора до 80 - 100 С почти 20 % кремнезема осаждается на какой-либо подходящей поверхности или в противном случае формируются коллоидные частицы. Согласно Аза-ряну [ 269а ], при получении этим способом тонких покрытий на порошках из бронзы и других металлов, например меди или алюминия, особенно благоприятно сказывается присутствие в растворе ацетата натрия. Как будет обсуждено в следующей главе, полисиликат лития, по-видимому, осаждает коллоидный кремнезем. [14]
Известно, что при нагревании концентрированного раствора силиката лития ниже 100 С он застывает сплошной белой аморфной массой, которая при охлаждении постепенно снова переходит в прозрачный жидкий раствор. Видимо, в этом случае не происходит образования связи Si-О - Li, но частично дегидратированный при повышении температуры катион осаждает крупные силикатные анионы. Аналогичное явление имеет место в производстве растворов полисиликатов лития автоклавным способом, когда полученная взаимодействием активного кремнезема с раствором LiOH система после остывания частично разжижается, образуя раствор полисиликата. [15]
Страницы: 1 2
www.ngpedia.ru
Полисиликаты лития
ХИМИЯ КРЕМНЕЗЕМА
Айлер [101] в 1954 г. обнаружил, что концентрированные устойчивые растворы с молярными отношениями Si02 : Li20 от 4:1 до 25 : 1 можно получать добавлением LiOH либо к раствору поликремневой кислоты, либо к суспензии геля кремнезема, либо к золю кремнезема, причем все реагенты должны быть свободны от ионов щелочных металлов или других катионов. Поскольку такие смеси сгущаются или же немедленно превращаются в гель, то подобный способ казался бесполезным до тех пор, пока не было обнаружено, что полученная масса самопроизвольно разжижается после выдерживания при комнатной температуре в течение нескольких часов (до суток). Если же с целью ускорения разжижения смеси нагревали до 80—100°С, то они оставались в желатинизированном состоянии. Жидкие составы содержали как ионную форму, так и коллоидный кремнезем.
Технические растворы полисиликата лития имеют следующие свойства [102]:
Полиснлнкат
S102, %
Li20, %
Молярное отношение
Si02: Li20 Вязкость. сП Плотность рН
Срок хранения при 24° С, мес
Поскольку составы во всем интервале отношений Si02 : Li20 от 4 : 1 до 25 : 1 растворимы и устойчивы, то такая предложенная Айлером система дает возможность изучать взаимосвязь между отношением содержания кремнезема к содержанию щелочи и природой присутствующих коллоидных разновидностей. Растворы полисиликата лития приготовляли смешиванием раствора поликремневой кислоты, полученного ионным обменом из силиката натрия с отношением Si02 : Na20 3,25 с раствором гидроксида лития. Эти смеси подвергали старению при 25°С в течение недели до получения прозрачных жидкостей в равновесном состоянии. Растворы содержали 10 % Si02 и имели отношения Si02 : Li20 в интервале от 3 : 1 до 10 : 1.
Такие растворы сравнивали между собой путем измерения скоростей образования желтой формы кремнемолибденовой кислоты. Процедура заключалась в мгновенном смешивании микроколичеств указанных растворов с раствором молибденовой кислоты при низких значениях рН. Для каждого образца отмечалась доля в процентах Р от полного содержания кремнезема, прореагировавшего при 25°С за определенное время /, равное 2,5; 5; 10; 15 и 20 мин. Рассматривался также раствор силиката натрия с молярным отношением Si02 : Na20 3,3 : 1,0. Было отмечено, что он реагирует с раствором молибденовой кислоты примерно таким же образом, как и раствор силиката лития с соответствующим отношением Si02 : Li20.
Принималось, что все растворы состояли в основном из мономерных силикат - и полисиликат-ионов с высокими молекулярными массами, причем полисиликатные ионы представляли собой очень небольшие заряженные коллоидные частицы. Так как мономерные ионы вступают в реакцию с молибдатом примерно в течение 2,5 мин, то в каждом случае отмечалась и доля в процентах Рт, относящаяся к мономерному кремнезему.
Следовательно, разность Р—Pmi или р, соответствовала процентному содержанию кремнезема в полимерном состоянии, который вступал в реакцию с молибдатом к моменту времени t. Изменение количества полимера в ходе реакции выражается следующим уравнением:
Lg 'V = kt (см. рис. 2. 4.)
Графическая зависимость величины относительной скорости реакции k от величины (R—2)-1 (где R — молярное отношение Si02 : Li20) представлена на рис. 2.5. Разность R—2 берется потому, что коллоидные разновидности присутствуют только при отношении R, большем чем 2:1. Поскольку, как уже отмечалось, скорость рассматриваемой реакции является обрат-
| (R ~2У' Рис. 2.5. Зависимость относительных скоростей реакции коллоидных разновидностей в растворах полисиликата лития с молибденовой кислотой от величины (R-2)-'. R — молярное отношение Si02 : ІЛ2О. |
| Рис. 2.4. Ход реакции коллоидных разновидностей кремнезема с молибденовой кислотой в растворах полисиликата лития при различных отношениях Si02: Li20 (указаны на кривых). |
Ной функцией от размера коллоидных частиц, то отсюда делается заключение, что размер коллоидных разновидностей равномерно и самопроизвольно должен возрастать пропорционально той степени, при которой отношение SiC>2 : Li20 превышает 2:1. Это по крайней мере справедливо для области отношений Si02 : Li20 от 3 : 1 до 10 : 1. При более высоких отношениях Si02 : Li20 размер частиц взаимосвязан с этими величинами в меньшей степени. Так, хорошо известно, что при отношениях Si02 : Li20, больших чем 25 : 1, стабилизация золей различающихся по размерам частиц почти не зависит от размера частиц.
Таким образом, полисиликатный раствор самопроизвольно достигает равновесия со смесью мономерных и коллоидных разновидностей, причем размер последних возрастает, когда отношение Si02 : Li20 больше, чем 2:1.
Были предложены многочисленные производственные технологические процессы. Например, был приготовлен полисиликат лития из 2,6 %-ного золя кремнезема [103]. Золь получали ионным обменом из силиката натрия с добавлением LiOH для достижения области отношений Si02 : Li20 от 2,5:1 до 8:1. Раствор затем концентрировали испарением в вакууме, что позволило повысить содержание кремнезема до 21 %. Как было указано автором, в растворе присутствовал в большей степени «кристаллоидный», чем коллоидный, кремнезем. Такой кремнезем получался вследствие того, что исходный золь, вероятно, содержал частицы кремнезема размером 1—2 нм.
Раствор полисиликата лития с молярным отношением Si02 : Li20 3,5 можно приготовить нагреванием тонкодисперсного аморфного кремнезема в растворе LiOH при молярном отношении 1,5 :1 [104]. Образующийся при повышенной температуре осадок после охлаждения разжижается до полисиликатного раствора с содержанием 23,4 % Si02. Очевидно, что силикат, выделяемый из горячего раствора, имеет более высокое отношение Si02 : Li20 по сравнению с отношением в оставшемся растворе [104]. Согласно Пэттону и Коксу [105], силикаты лития с молярными отношениями от 2 : 1 до 6,3 : 1 могут приготовляться аналогичным образом при 75—150°С с сохранением осадка в суспензии и с последующим охлаждением, для того чтобы оказать воздействие на весь раствор. Полисиликат можно также приготовлять растворением порошка кремния в растворе LiOH при 50—80°С в присутствии Си(ОН)2 в качестве катализатора [106].
Наличие некоторого количества силиката лития в растворах силиката натрия или силиката калия, очевидно, дает некоторые преимущества [107, 108].
Высокие значения удельной поверхности и скорости растворения аморфного кремнезема позволяют проводить необходимые реакции при значительно более низких температурах, чем это требуется для измельченного в порошок кристаллического кремнезема. Повышенная химическая реакционная …
Для некоторых применений желательно, чтобы поверхность кремнезема или стекла смачивалась водой. Но в то же время должны отсутствовать различные характерные ионные, гидрофобные или водородные связи, которые возникают при адсорбции органических …
Несомненно, что наиболее древними ископаемыми остатками живых организмов являются сине-зеленые водоросли, обнаруженные в виде включений в шерте (микрокристаллическом кремнеземе), открытые Баргхорном и Тайлером [12] и в дальнейшем изученные многими исследователями …
msd.com.ua
Литий полисиликаты - Справочник химика 21
Поскольку силикаты лития резко отличны по своему поведению от силикатов натрия и калия, то полисиликаты лития рассматриваются в настоящей главе отдельно. [c.197]Айлер [204] обнаружил, что гидроксид лития непохож на гидроксид натрия и в том отношении, что может быть добавлен к золю в качестве стабилизатора в любом количестве, не вызывая процесса коагуляции. Таким образом, золи, имеющие соотношения 5102 20 в интервале от 4 1 до 25 1, оказываются устойчивыми, совместимыми с органическими жидкостями, смешивающимися с водой, и при высушивании образуют водостойкие пленки (см. гл. 2, разд. Полисиликаты лития ). [c.489]
Природные соединения и получение лития. Суммарное содержание лития в земной коре 3,4-10 %. Он входит в состав многих минералов, содержится в каменных углях, почвах, морской воде, а также в лсивых организмах и растениях. Промышленным минералом лития является сложный полисиликат сподумен Ь1А1[8120б]. При вакуум гермическом восстановлении сподумена или оксида лития в технике в качестве восстановителя применяют кремний или алюминий. При электролитическом восстановлении используют эвтектическую смесь (для понижения температуры) хлоридов лития и калия. Содержание основного металла 99,4%. Электролиз расплавов с применением эвтектики из хлорида и бромида лития дает особо чистый металл. [c.304]Полисиликаты лития используются наиболее широко в качестве связующего для антикоррозионных покрытий на основе цинка. Такие покрытия обладают высокой устойчивостью в морской воде, в различных грунтовых водах. Существует много вариантов цинковых антикоррозионных покрытий с использованием силикатов или полисиликатов лития, отличающихся различными добавками, модифицирующими то или иное свойство покрытия. Например, тонкие пленки силикатов лития служат для защиты оптических стекол. [c.38]
Технические растворы полисиликата лития имеют следующие свойства [102] [c.201]
Рпс. 2.5. Зависимость относительных скоростей реакции коллоидных разновидностей в растворах полисиликата лития с молибденовой кислотой от величины [c.203]
Применение силикатов и полисиликатов лития [c.205]
Некоторые трудности, встречающиеся при использовании обогащенных цинком красок, связанных с полисиликатами лития, были рассмотрены в обзоре Райта [117]. Он указал, что медленно происходящая при хранении реакция между цинком и связующим веществом в процессе старения материала вызывает ухудшение качества окончательно получаемого покрытия. [c.205]
Связующие свойства полезны и для других пигментных покрытий, таких, например, как краски на основе глин [119]. Цинк-литиевые силикатные покрытия могут быть получены посредством анодного электролитического осаждения на стали [120]. Другим применением полисиликата лития является уменьшение липкости кухонной посуды [121], что обеспечивается за счет способности полисиликата лития образовывать промежуточное соединение, связывающее между собой фтор-углеводородное полимерное покрытие и металл. [c.205]
Эти полисиликаты, очевидно, отличались от ранее упоминавшихся кристаллических полисиликатов натрия, однако имели сходные ионообменные свойства. Были также изучены системы, содержавшие ионы и К" при различных соотношениях кремнезем—щелочь. Можно было ожидать образования кристаллических силикатов для литиевой системы, но результаты опытов автора настоящей монографии, выполненных с калиевой системой, свидетельствуют о том, что нерастворимые полисиликаты лития и калия нельзя получить при тех же условиях, при которых формируются полисиликаты натрия. [c.221]
Применение силикатов и полисиликатов лития..................205 [c.414]
Кремнезем быстро деполимеризуется в присутствии сильной щелочи. Таким образом, коллоидный кремнезем можно превратить в раствор полисиликата натрия, содержащий 4,2— 6,0 моль кремнезема на один моль оксида натрия [738], или в раствор полисиликата лития и стабилизированный литием золь с соотношением 4—25 моль кремнезема на один моль оксида лития [739]. Такие составы не могут быть получены посредством растворения силикатных стекол натрия или лития, так же как не могут приготовляться растворением песка в щелочи, поскольку силикат лития не растворим в горячей воде. При более низких силикатных отношениях приготовление растворов из коллоидного кремнезема имеет преимуществом лишь большую скорость реакции. [c.608]
В отличие от Айлера, нами был получен ряд полисиликатных растворов лития растворением в щелочи высокополимерных форм кремнезема различных золей и аэросила с удельной поверхностью 175 м /г, а также растворением щелочи в золях. Золи имели средний диаметр частиц 10—13 нм и были стабилизированы натриевой или литиевой щелочью. После смещения компонентов образовывалась густая масса, которая разжижалась на 2—4-е сутки старения при комнатной температуре. На 3—5-е сутки раствор полиСиликата из золей просветлялся до небольшой опалесценции, а из аэросила — оставался непрозрачным молочного цвета, т. е. состоял из слишком крупных частиц. Все растворы содержали 20 масс. % 5102. [c.70]Известно, что при нагревании концентрированного раствора силиката лития ниже 100 °С он застывает сплошной белой аморфной массой, которая при охлаждении постепенно снова переходит в прозрачный жидкий раствор. Видимо, в этом случае не происходит образования связи 51—О—но частично дегидратированный при повышении температуры катион осаждает крупные силикатные анионы. Аналогичное явление имеет место в производстве растворов полисиликатов лития автоклавным способом, когда полученная взаимодействием активного кремнезема с раствором ЬЮН система после остывания частично разжижается, образуя раствор полисиликата. [c.103]
Прочная многослойная гидратная оболочка катиона лития, возможно, обусловливает устойчивость весьма концентрированных и высокомодульных растворов силиката и полисиликата лития при хранении, в отличие от калиевых и особенно натриевых растворов, которые при модулях выше 4 обладают малой жизнеспособностью и склонны к самопроизвольному гелеобразованию. [c.103]
Вероятно, только с 1950 г. был признан тот факт, что устойчивые растворы силикатов и полисиликатов лития можно готовить с любым желаемым отношением SiOa L12O и что такие растворы обладают полезными свойствами. [c.200]
Поскольку составы во всем интервале отношений 5102 ЫзО от 4 1 до 25 1 растворимы и устойчивы, то такая предложенная Айлером система дает возможность изучать взаимосвязь между отношением содержания кремнезема к содержанию щелочи и природой присутствующих коллоидных разновидностей. Растворы полисиликата лития приготовляли смешиванием раствора поликремневой кислоты, полученного ионным обменом из силиката натрия с отношением З Ог N320 3,25 с раствором гидроксида лития. Эти смеси подвергали старению при 25°С в течение недели до получения прозрачных жидкостей в равновесном состоянии. Растворы содержали 10 % 5102 и имели отношения 5102 Ь120 в интервале от 3 1 до 10 1. [c.202]
Были предложены многочисленные производственные технологические процессы. Например, был приготовлен полисиликат лития из 2,6 %-ного золя кремнезема [103]. Золь получали ионным обменом из силиката натрия с добавлением LiOH для достижения области отношений SIO2 LisO от 2,5 1 до 8 1. Раствор затем концентрировали испарением в вакууме, что позволило повысить содержание кремнезема до 21 %. Как было указано автором, в растворе присутствовал в большей степени кристаллоидный , чем коллоидный, кремнезем. Такой кремнезем получался вследствие того, что исходный золь, вероятно, содержал частицы кремнезема размером 1—2 нм. [c.204]Полисиликаты лития в основном используются как противокоррозионные покрытия, содержащие тонкодисперсный цинк, в которых кремнезем играет роль неорганического связующего вещества [109, 110]. Добавление органосиликоната улучшает водостойкость покрытия [111]. Сообщается, что подобный состав годится как связующее вещество для тормозных накладок [112]. Возможное добавление в этот состав небольшого количества эмульсии стирол-акрилового сополимера ведет к улучшению адгезии к стали [ИЗ]. Другой добавкой, способной улучшить стойкость полисиликатов к морской воде, является небольшое количество гидроксида бария [114]. Согласно Дюпре и Бумену [115], силикат бария более растворим, чем соль кальция или стронция, поэтому в растворе будет достаточное количество силикат-ионов, способных ингибировать коррозию алюминия под действием щелочи. Адгезия и способность к связыванию грунтовых лаков, обогащенных цинком, соединенных с полисиликатом лития, были улучшены замещением некоторого количества дифосфида железа или кадмия на цинк [116]. [c.205]
Оценивалось несколько типов растворимых силикатов, но однако лишь полисиликат лития с отношением SiOa LiaO - 5 1 оказался удовлетворительным при использовании цинковой пыли с размером частиц 2—3 мкм. Преимущество лития выражалось главным образом в том, что смеси оказывались более стабильными [118]. [c.205]
Как уже было рассмотрено в гл. 2 в связи с вопросом о силикатах и полисиликатах лития, ионы лития исключительны в том о-рношении, что способны предпочтительно адсорбироваться на поверхности кремнезема, формируя непроницаемый слой, который замедляет процесс растворения кремнезема при высоких значениях pH [206]. [c.489]
Шоуп приготовил гели кремнезема, обладающие очень высокой прочностью, из смесей силиката калия и коллоидного кремнезема, о чем уже упоминалось при рассмотрении вопросов о полисиликате калия в гл. 2 (см. лит. к гл. 2 [97, 96]). Такие композиции могут иметь высокую прочность связи в тех случаях, когда допускается присутствие небольших количеств соли калия. [c.582]
Вместо более широко применяемого силиката с отношением 5102 НагО 3,25 1 использовался полисиликат натрия, поскольку первый оказывается несовместимым с коллоидным кремнеземом, вызывая его застудневание даже перед подкислением. Шоуп описал изготовление изделий с использованием подобного процесса гелеобразования (см. лит. к гл. 2 [96]). [c.727]
В. Г. Ильин (Институт физической химии им. Л. В. Писаржевского АН УССР, Киев). Синтезированные нами недавно пористые кристаллические полисиликаты и поликремниевые кислоты могут существенно дополнить группу слоистых минералов с расширяющейся решеткой [см. Докл. АН СССР,] 209, 1102 (1973)). Благодаря однородной структуре, составу и отсутствию примесей (неизбежных в природных сорбентах) эти препараты, по-видимому, позволят в более явном виде определить общие закономерности, связывающие адсорбционные свойства и пористость. Синтез полисиликатов осуществляется низкотемпературной гидротермальной кристаллизацией щелочных силикатных систем. К настоящему времени наиболее полно изучена система N320—3102—Н2О, но получены также полисиликаты лития и калия. [c.70]
Помимо высокой устойчивости, литиевые растворы гораздо более совместимы с водорастворимыми органическими веществами, чем натриевые или калиевые. Айлером исследованы состарившиеся в течение недели системы водных полисиликатов лития, полученные смешением растворов низкомолекулярной кислоты и гидроокиси лития. В этих системах определяли изменение содержания Растворимого кремнезема во времени. По скорости взаимодействия Нолисиликатов лития с молибденовой кислотой было определено, то размер коллоидных частиц, самопроизвольно образовавшихся Ри получении полисиликатов, увеличивается с возрастанием модуля. Эта связь прослеживается до модуля 10. Отсюда следует, что [c.69]
Так же как и при растворении золей в калиевой щелочи (см. рис. 35), содержание а-510г в первый период оказывается значительно выше, чем в последующем, и в течение 100 сут наблюдаются затухающие колебания а-формы кремнезема. Видимо, растворение золя в щелочи идет через образование мономеров в растворе, которые со временем полимеризуются, но, в отличие от золя, при комнатной температуре сохраняют гидратированную форму и легко титруются с ЫаР. Все синтезированные растворы полисиликатов лития сохраняются больше года. Таким образом, растворы полисиликатов лития, приготовленные из высокополимерных форм кремнезема, при комнатной температуре отличаются от растворов, приготовленных из малополимерной кремневой кислоты, наличием золевой составляющей, которая длительно сохраняется в растворе. [c.71]
Цинковые краски требуют отверждения для большинства предложенных рецептов. Это может быть термонагрев (3 ч при 230 °С) или внесение в атмосферу СОг, или обработка раствором кислоты после сушки. Были предложены самоотверждающиеся водостойкие цинковые краски на основе полисиликата лития с модулями 4,8 и 8,0. Как и на алюминии, на цинке при обработке силикатом натрия образуется тонкая нерастворимая пленка. Чтобы краска стала водостойкой, вероятно, необходимо, чтобы контактное расстояние между частицами цинка в краске было соизмеримо с толщиной этой пленки. Поэтому дисперсность порошков для цинковых красок очень высока и строго регламентирована в дозировке каждой градации. [c.125]
chem21.info
Способ получения полисиликата лития
Использование: изготовление пленок различного назначения, в-качестве компонента в композиционных материалах, в частности для изготовления антибликовь4Х покрытий на экранах кинескопов. Сущность изобретения: гидролиз тетраэтоксисилана (ТЭ О С) ведут при следующих массовых соотношениях ТЭОС: вода: гидроксид лития 1:
СОЮЭ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (я)л С 01 В 33/20
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4864985/26 (22) 10.07.90 (46) 15.11,.92.БюлЛ№ 42 (71) Всесоюзный научно-исследовательский институт химических реактивов и особочистых химических веществ (72) О.Н.Емельянова, А,Ф.Логинов, И.К.Григорьева и Е.П,Кудрявцева (56) Заявка Великобритании ¹ 2075003, кл.
С 03 В 19/06, 1981.
Изобретение относится к химической промышленности, а именно к способу.получения раствора поликсиликата лития (литиевого силикаэоля), предназначенного для изготовления пленок различного назначения и для использования в составах композиционных материалов, в частности для изготовления антибликовых покрытий на экранах кинескопов, Наиболее близким к предлагаемому по техническим приемам и использованию исходных материалов является способ (заявка
Великобритании ¹ 2 075 003 кл. С 03 В
19/06, 1981.), заключающийся в гидролизе алкоксисилана, в частности Я(ОСНз)4 в интервале рН 9,5-11,5 в присутствии аммиака или гидроксида щелочного металла (NaOH, КОН, LIOH, RbOH) при их концентрации 3 10 -1 . 10 моль/л, Гелеобра -4 . . -2 зование при этом происходит в течение 5 мин.
„, Ы„„1775358 А1 (54) СПОСОБ ПОЛУЧЕНИЯ ПОЛИСИЛИКАТА ЛИТИЯ (57) Использование: изготовление пленок различного назначения, в-качестве компонента в композиционных материалах, в частности для изготовления антибликовых покрытий на экранах кинескопов. Сущность изобретения; гидролиз тетраэтоксисилана (ТЭОС) ведут при следующих массовых соотношениях ТЭОС: вода: гидроксид лития
1:(1,1-7,5):(9 10 -4,6 10 ) при 20-70ОС в течение 0,5-6 ч.
Недостатком указанного способа является получение продукта гидролиэа в виде геля, что неприемлемо для целей предлагаемого изобретения, Целью предлагаемого способ является получение полисиликата лития в виде устойчивого концентрированного пленкообразующего золя.
Сущность предлагаемого способа заключается в том, что гидролиз тетраэтоксилана ведут при массовом соотношснии
T3OC:Н20:ВОН=1:(1,1-7,5):(9 10 з-4,6 . 10 2) в интервале температур 20-70 С в течение
0,5-6 часов.
Предлагаемый способ обладаетследующими преимуществами:
1) процесс позволяет провести гидролиз ТЭОС с получением золя полисиликата лития и получить продукт с содержанием
3,0-12,0/ Si02 в эоле, что обеспечивает получение высококачественных прочных влаго1775358
55 стойких антибликовых покрытий на экранах кинескопов;
2) получаемый в результате гидрслиза пленкообраэующий состав, содер>кащий до
40;ь этанола, обеспечивает более быстрое высыхание нанесенных покрытий по сравнению с водными литиевыми "-олями;
3) по сравнению со всеми известными способами получения литиевых золей процесс значительно упрощается за счет получения конечного продукта в одну стадию без предварительного получения диоксида кремния (в виде геля. активной кремневой кислоты или порошка) с последующим его взаимодействием с LIOH; существенно сокращается (с 8-20 ч до 0,5-6 ч ) время процесса;
4) при одностадийном процессе получения литиевого силиказоля из алкоксисилана значительно снижаются трудоемкость и энергетические затраты.
Использование !ОН в качестве катализатора щелочного гидролиэа алкоксисилана в приведенном интервале соотношений компонентов позволяет решить задачу получения устойчивых пленкообраэующих золей в интервале молярных соотношений
SiOz/Liz0 (модулей) от 5 до 25 и содержании
Si0z в растворе от 3 до 12%. Для нанесения силикатных покрытий на различных подложках в один или несколько слоев, в частности, для антибликовых покрытий на кинескопах обычно используются золи с содер>канием SI02 1,5-3,0 мас, ;, и модулями
5,0-15,0, Таким образом, описанные в предлагаемом изобретении составы могут быть использованы непосредственно как товарный продукт.
Содержание этилового спирта в продукте гидролиза не снижает качества покрытий на подложках и ведет к более быстрому высыханию слоев покрытия и может яи яться заметным преимуществом предлагаемого процесса. Однако для удобства хранения и транспс тировки может быть использован метод концентрирования золя частичной отгонкой водно-спиртовой смеси иэ полученного гидролизата при нормальнсм давлении или под вакуумом до содержания
Si0z 20-22 мас., Предпочтительным с экологической точки зрения для получения товарно-о литиевого силикаэоля является использование тетраэтоксисилана, однзко, гидролиз с получением аналогичного продукта может быль осуществлен и с использованием других алкоксисиланов, а частности тетраметоксисилана.
Интервал соотношений компонентов
ТЗОС:Н2О.LiOI- в предлагаемом способе ограничен следующими факторами при соотношении ТЭОС:Н20>1:1,1 гидролиэ протекает с образованием геля; при соотношении ТЭОС;Н201:4,6 10 2, соответствующих модулям >25, гидролиз протекает активно, однако получаемые эоли не соответствуют оптимальному составу, обеспечивающему требуемое качество покрытий; рекомендуемая минимальная температура процесса (20 С) связана с максимальным временем процесса, поэтому дальнейшее снижение температуры нецелесообразно; повышение температуры>70ОC ведет к флокуляции осадка гидратированного Я!02 в процессе гидролиза; минимальное время процесса (0,5 ч) получения золя может быть достигнуто при высоких значениях модулей (М= 20-25) и температуре процесса 50-70 С; увеличение времени процесса сверх 6 ч не приводит к новому качеству продукта в данном интервале соотношений исходных компонентов, Пример 1. В круглодонную трехгорлую колбу, помещенную в электрическую баню и соединенную с прямым холодильником, заливают 93 r ТЭОС и 150 мл водного раствора, содержащего 1,5 г LiOH h30, и при перемешивании ведут гидролиз при
50 С в течение 6 ч. Получают эоль с содержанием SIOz 12,17;. После отгонки водноспиртовой смеси при 82-98 С при нормальном давлении получают пленкообразующий золь с содержанием Sl02 21,9 Я и модуляем 25,0, устойчивый при хранении в течение 8 мес.
Массовое соотношение компонентов при гидролиэе ТЭОС:h30:LIOÍ=1;1,1:9 10 .
Пример 2. В круглодонную колбу заливают 50 мл ТЭОС и 350 мл воды с растворенным в ней 3,75 г LiÎH . Н20 (соотношение ТЭОС:Н20:LiOH=1:7,5:4,6 10 ) и гидролиз ведут в течение 0,5 ч при темперагуре 40-45" С. Полученный гидролиэат представляет собой устойчивый
1775358
Пример 4. Гидролиз исходных компонентов, взятых в таких же соотношениях, как в примере 3. ведут при 20 С в течение
4,5 ч и получают устойчивый пленкообразуСоставитель О.Емельянова
Техред М;Моргентал Корректор П.Гереши
Редактор В.Бер
Заказ 4016 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5
Производственно-издательский комбинат "Патент", г. Ужгород, ул.Гагарина, 101 пленкообразующий золь с содержанием
SiOz 3,47ь и модулем 5,0.
Пример 3. К 25 мл ТЭОС добавляют
38 г водного раствора, содержащего растворенную навеску 0,5г LIOH Hz0 (соотношение ТЭОС:HzO: LI OH=1:1,6:1 10 ).
Гидролиз ведут при температуре 65-70 С в течение 2 ч и получают устойчивый пленкообразующий золь с содержанием SIOz
11,1 7ь. ющий золь с содержанием SIOz 11,1 и модулем 18,8.
Формула изобретения
Способ получения полисиликата литии, 5 включающий гидролиз алкоксисилана в присутствии раствора гидроксида лития. о тл и ч а ю шийся тем, что, с целью обеспечения возможности получения продукта в виде устойчивого пленкообразующего золя, t0 в качестве алкоксисилана используюттетраэтоксисилан и гидролиз ведут при следующих массовых соотношениях компонентов, тетраэтоксисилан: вода: гидроксид лития=1:(1,1-7,5):(9 ° 10 -4,6 10 ) при 20-70 С
15 в течение 0,5-6 ч.



Похожие патенты:

Изобретение относится к способам растворения силиката натрия, применяемого в производстве алюмосиликатных катализаторов , цеолитов, силикатных клеев, и позволяет снизить шламообразование при растворении

Изобретение относится к способу получения раствора полисиликата лития, применяемого для изготовления пленок, в частности антибликовых покрытий на экранах кинескопов в составах композиционных материалов и позволяет упростить процесс , сохранив низкую вязкость продукта

Изобретение относится к литейному производству, а именно к установкам для получения жидкого стекла, применяемого в качестве связующего при изготовлении форм и стержней

Изобретение относится к способам растворения силиката натрия, применяемого в производстве алюмосиликатных катализаторов , силикатных клеев и связующих материалов , и позволяет повысить скорость растворения

Изобретение относится к строительным материалам, может быть использовано для производства жидкого стекла перед его применением, а также непосредственного применения порошков гидратированных щелочных силикатов в различных отраслях промышленности и позволяет повысить скорость растворения продукта и уменьшить нерастворившийся остаток

Изобретение относится к способам полученир жидкого стекла, применяемого в производстве стройматериалов, силикатныхкрасок s химической, машиностроителе., текстильной, бумажной промышленности, черной металлургии, при флотации медио-мошбденоеых руд, и позволяет повысить чисто гу продукта и упростить процесс

Изобретение относится к способам получения жидкого стекла, применяемого для производства стройматериалов , и позволяет снизить энергозатраты на сушку глинистых суспензий, полученных на основе продуктов, за счет снижения водосодержання суспензий при сохранении вязкости продукта и сокращения времени проведения процесса

Изобретение относится к способам получения жидкого стекла, применяемого в производстве стройматериалов для регулирования свойств глинистых суспензий шликеров, цементных сырьевых шламов в технологии керамической плитки, бетонов, стеновых материалов и цементного клинкера с мокрым способом подготовки, и позволяет снизить вязкость глинистых суспензий и сократить время проведения процесса

Изобретение относится к способам получения жидкого стекла, применяемого в производстве стройматериалов для повышения водонепроницаемости бетонов, для получения шлакощелочного вяжущего, для регулирования свойств глинистых суспензий , и позволяет обеспечить возможность эффективного использования низкокальциевых зол-уноса ТЭС

Изобретение относится к способам получения метасиликата натрия, применяемого в стекольной промышленности, и позволяет повысить выход продукта

Изобретение относится к структурообразующей добавке для детергентной композиции, образованной водным раствором силиката щелочного металла, а именно натрия или калия, с молярным соотношением SiO2/M2O порядка 1,6 - 4, и неорганическим продуктом, инертным по отношению к силикату, причем вышеуказанный неорганический продукт составляет 5 - менее 55% от общего веса, в расчете на сухой вес, и весовое соотношение, остаточная вода, связанная с силикатом/силикат, в расчете на сухой вес, выше или равно 33/100, предпочтительно 36/100
Изобретение относится к способу получения водорастворимых силикатов из золы рисовой шелухи и может быть использовано при переработке отходов рисового производства с целью получения жидкого стекла для его использования в жировой, мыловаренной, химической, машиностроительной, текстильной, бумажной промышленности, для производства сварочных электродов, при изготовлении форм и стержней в литейном производстве и других отраслях
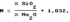
Изобретение относится к химической технологии, в частности к получению гелеобразующих водных растворов силиката натрия с высоким силикатным модулем

Изобретение относится к способу получения жидкого стекла, которое используется в строительстве, в нефтедобывающей промышленности

Изобретение относится к способу получения полисиликатов натрия, которые могут быть использованы в нефтедобывающей промышленности при гидроизоляции скважин, а также для изготовления водостойких теплоизоляционных материалов

Изобретение относится к технологии получения жидкого стекла для производства строительных материалов

Изобретение относится к получению жидкого стекла

Изобретение относится к промышленности строительных материалов и может быть использовано при производстве композиционных силикатных строительных материалов, пористых тепло- и звукоизоляционных материалов, клеевых твердеющих составов, адсорбентов, а также в других областях, использующих растворы силикатов натрия
Изобретение относится к технологии получения жидкого стекла, применяемого в качестве вяжущего, добавки или реагента в строительной, нефтедобывающей и других отраслях производственной деятельности
Способ получения полисиликата лития
www.findpatent.ru
Полисиликаты - Справочник химика 21
Поскольку силикаты лития резко отличны по своему поведению от силикатов натрия и калия, то полисиликаты лития рассматриваются в настоящей главе отдельно. [c.197]Жидкое стекло необходимо быстро использовать или хранить в закрытых емкостях ввиду возможного испарения воды и, следовательно, повышения концентрации. Это может привести к разложению полисиликатов натрия и коагуляции всей массы н идкого стекла. Обычно жидкое стекло, оставленное открытым, через некоторое время покрывается желатинообразной коркой, которая при дальнейшем высыхании рассыпается в порошок. При хранении жидкого стекла на открытом воздухе в течение длительного времени в результате взаимодействия его с двуокисью углерода (из воздуха) выделяется кремневая кислота. Низкая температура на жидкое стекло не действует, особенно если оно хранится в закрытых емкостях. [c.39]
Растворы в указанной области будем называть в данной книге полисиликатами , подразумевая, что образовавшиеся [c.156]Природные соединения и получение лития. Суммарное содержание лития в земной коре 3,4-10 %. Он входит в состав многих минералов, содержится в каменных углях, почвах, морской воде, а также в лсивых организмах и растениях. Промышленным минералом лития является сложный полисиликат сподумен Ь1А1[8120б]. При вакуум гермическом восстановлении сподумена или оксида лития в технике в качестве восстановителя применяют кремний или алюминий. При электролитическом восстановлении используют эвтектическую смесь (для понижения температуры) хлоридов лития и калия. Содержание основного металла 99,4%. Электролиз расплавов с применением эвтектики из хлорида и бромида лития дает особо чистый металл. [c.304]
Добавление компонентов, таких, как полисиликаты, усиливает указанный эффект, так как их анионы, действуя подобно мицеллам, связывают натриевые ионы. Это действие аналогично точно такому же действию этих же смесей в отношении более опасных многовалентных катионов (Са2 + М + и т, д.). [c.80]
Напротив, тетраэдры 3104 в полисиликатах связаны через вершины [c.359]
Строят сиектры синей и розовой форм поверхностного полисиликата в координатах. / в=/(Я) на одном листе. Сопоставляют наблюдаемые полосы с возможными с1— -электрон-ными переходами по рис. 8,9. [c.174]
Ко всем этим кремневым кислотам, существующим только при определенных значениях pH и в определенных интервалах температур и известным в виде своих разнообразных солей, применяют общее название поликремневые кислоты. Соли поликремневых кислот называют полисиликатами. [c.491]
Полимеры, в состав которых не входят атомы углерода, получили название неорганических. Среди неорганических полимеров много природных типа полисиликатов. Некоторые элементарные вещества являются полимерами (селен, теллур и др.). В настоящее время широко ведутся исследования с целью получения синтетических неорганических полимеров. [c.392]
Силикаты и алюмосиликаты. Самыми распространенными сложными соединениями — неорганическими полимерами являются оксиды кремния, алюминия и других металлов. Основу земной коры составляют силикаты и алюмосиликаты, на долю которых приходится в базальтовых породах около 50 и 16% (масс.) соответственно. Состоят эти неорганические полимеры из тетраэдров (Si04) и (AIO4) , октаэдров (АЮб) . Ионы ортосиликата могут объединяться за счет общих атомов кислорода, образуя при этом длинные цепи полисиликатов вида [c.612]
Основной вывод заключается в том, что коллоидные разновидности присутствуют в растворах силиката натрия только в том случае, когда отношение ЗЮг КагО превышает 2 1, и что при более высоких значениях отношений основная доля кремнезема находится в растворе в виде полисиликат-ионоз или частиц, имеющих в основном диаметр менее 30 нм. [c.176]
Силикат щелочного металла высаливается из раствора особенно легко в том случае, когда отношение SiOa NajO превы-гиает 2 1. Тот факт, что осадок может растворяться в воде, является подтверждением возможности образования полисиликат-ионов, связанных между собой посредством координационной связи через ионы натрия. Подобные связи должны сохраняться только лишь в присутствии значительного избытка ионов натрия. [c.184]
Кажется вполне вероятным, что при высоких концентрациях соли катионы способствуют связыванию полиионов (по типу поперечных связей) благодаря их способности координировать с кислородными атомами полисиликата, которые замещают координационно связанную воду на этих катионах. Этот процесс должен быть обратимым при добавлении к раствору воды. С другой стороны, полимеризация, вызываемая присутствием кислоты, приводит к образованию силоксановой мостиковой связи (81—О—81) между полисиликат-ионами, которые не разрываются прн разбавлении. [c.186]
Силикатными материалами называются материалы из смесей или сплавов силикатов, полисиликатов и алюмосиликатов. Они представляют широко распространенную группу твердофазных материалов, то есть веществ, обладающих совокупностью свойств, которые определяют то или иное их пргистическое применение (И.В. Тананаев). Так как главным в этом определении материала является признак его применимости, то к группе силикатных материалов относят и некоторые бессиликатные системы, применяемые для тех же целей, что и собственно силикаты. [c.304]
М13СТ0 при приготовлении УЩР, а действием силиката иатрия. При этом предполагается увеличение относительного содержания полисиликатов в жидком стекле, так как часть щелочи, образующейся в результате гидролиза, расходуется на извлечение гуминовых веществ из бурового угля и, следовательно, степень пщролиза моносиликатов возрастает. [c.201]
Продукты конденсации поликремниевой кислоты с хлоридами Представляют собой полисиликаты оксихлоридов соответствующих элементов, т. е. твердые соединения, наследующие высокомолекулярный кремнекислородный остов поликремниевой кислоты. Все эти продукты при нагревании, например, до 180° С легко гидролизуются парами воды, превращаясь при этом в соответствующие гидроксиполисиликаты. Так, полисиликат гидроксититана получается в результате следующей реакции [c.203]
Таким образом, около 8% ОН-групп не вступают в реакцию (А), так как, очевидно, некоторые гидроксильные группы находятся в слишком узких порах или замкнутых полостях силикагеля. Стехиометрическое отношение Ti l=l подтверждало тот факт, что продуктом данной реакции является действительно триокси-хлорид полисиликата титана [Si02]i,sa0i,5(Ti l) (продукт, I в табл. 7). [c.204]
Очевидно, rpynnH = TiOH расположены на поверхности полисиликата тригидроксититана — продукта первого цикла молекулярного наслаивания — на больших расстояниях друг от друга, чем группы =Si — ОН силикагеля. Поэтому реакция (А) одновременно протекает как при участии одной ОН-группы, так и двух ОН-групп этого продукта [c.206]
Как отмечалось в начале настоящей главы, силикаты с отношениями Si02 Na20 от 4 1 до 25 1 обычно называются полисиликатами . В них содержание ионов натрия и силикат-ионов значительно ниже, чем в обычных растворимых силикатах с отношениями менее 4 1. Однако и в них содержание щелочи заметно больше, чем это необходимо для стабилизации золей в виде частиц с наименьшими размерами, которые производятся и продаются как коллоиды. [c.196]
Продукты конденсации представляют собой полисиликаты окси-хлоридов соответствующих элементов, т. е. твердые соединения, которые наследуют остов поликремниевой кислоты. Все эти продукты при нагревании легко гидролизуются, превращаясь в гидро-ксиполисиликаты [c.43]
Примерно в 1950 г. в поисковых работах, выполняемых с целью получения концентрированных стабилизированных щелочью золей кремнезема, было обнаружено, что, чем меньше размер частиц, тем большее количество щелочи и более низкое отношение ЗЮг МагО требуется для стабилизации системы. Однако в области отношений иримерно от 4 1 до 25 1 составы с пониженной концентрацией натрия оказывались, как правило, нестабильными и в конце концов превращались в гель. Когда раствор силиката натрия с отношением 3,25 добавлялся к концентрированному золю кремнезема, с тем чтобы понизить отношение 8102 КааО, например, от 100 1 до 5 1, то немедленно образовывался гель. Тем не менее Айлер [89] обнаружил, что при старении или нагревании подобной смеси получалась вновь устойчивая жидкость. Таким образом, растворы с отношениями от 4,2 1 до 6 1 при содержании в них 10—30 % 8102 могли быть приготовлены из исходных золей, содержащих вначале частпцы с типичными размерами 5—25 им. Однако более продолжительное нагревание вызывает дестабилизацию такой смеси, и снова начинает появляться нерастворимый кристаллический полисиликат или гель. Полисиликатный раствор иредставляет собой светлую прозрачную жидкость с низкой вязкостью, в которой примерно половина кремнезема присутствует в виде растворимого или ионного силиката, о чем свидетель- [c.197]
До настоящего времени силикат- и полисиликат-иоцы не изучены достаточно хорошо. Основное различие между полисиликат-ионами и очень небольшими отрицательно зарял ен-ными частицами коллоидного кремнезема, вероятно, заключается лишь в терминологии. Раньше казалось, что растворы силикатов щелочных металлов, полученные растворением в воде натриевого (или калиевого) силикатного стекла, безусловно, отличаются от золей коллоидного кремнезема, стабилизированного незначительным количеством щелочи. Силикатные растворы приготовлялись растворением силикатных стекол, имевших отношения 5102 ЫагО (модуль) меньше, чем 4 1. Поскольку такие стекла не растворяются, если содержат больше кремнезема или меньше щелочи, то силикатные растворы с отношениями, превышающими 4 1, ранее не применялись. [c.156]
По мере того как отношение З Ог МззО становится больше, чем 2 1, из различных циклических полисиликат-ионов, находящихся в небольших количествах в растворе, начинают формироваться полнциклические олигомеры. Вначале это трехмерные корпускулярные коллоидные разновидности, которые становятся зародышами протекающего затем процесса, когда при более высоких соотношениях 510г Ма20 образуются еще большие по размерам коллоидно-ионные разновидности., [c.172]
В тех растворах, в которых на один атом кремния приходилось менее чем 0,75 величины отрицательного заряда (ЗЮг Na20 = 2,67 1), концентрация мономера Si(0H)4 достигала значения, приблизительно равного растворимости коллоидного кремнезема (0,012% при 25°С и 0,216% при 50°С). Б этих случаях происходило формирование коллоидных разновидностей кремнезема. Таким образом, растворы силиката натрия с отношениями выше чем 2,6 содержали не только мономерные ионные разновидности и тетрамер, но также и полисиликат-ионы с более высокими молекулярными массами или же очень небольшие коллоидные частицы, несущие отрицательныа заряды. [c.179]
Эти результаты показывают, что когда раствор подвергается старению при концентрации 0,3 % 5102, то коллоидные частицы размером 1—2 нм, перешедшие из исходного 10 %-ного силикатного раствора, действуют как зародыши. На таких зародышах осаждается мономерный кремнезем, выделившийся при гидролизе силикат-ионов. С другой стороны, если 10 %-ный раствор сразу же разбавляется до 0,03 % 5102 или до концентрации 5- 10- М, то pH составляет 10,26 и весь кремнезем переходит в раствор в виде 51 (ОН)4 и ионов Н510.7. При этом даже имевшиеся в исходном растворе полисиликат-ионы диаметром 1—2 нм, т. е. коллоидные частицы, медленно переходят в разбавленный раствор. Как было показано в гл. 1, общая растворимость кремнезема, включая мономерные разновидности [c.183]
Более детально влияние солей натрия, например хлорида или сульфата, на растворы силиката натрия рассмотрено Вейлом [1]. Так, хлорид натрия вызывает выделение осадка силиката натрия, который более богат кремнеземом, чем исходный раствор. Меньшие количества хлорида натрия, а также сульфат п карбонат натрия повышают вязкость растворов силиката натрия. По-видимому, добавляемая соль натрия вызывает процесс коагуляции коллоидных частиц или полисиликат-ионов с высокой молекулярной массой, но мало влияет на метасиликат-ионы. [c.184]
Действие соли на степень полимеризации полисиликат-ионов в водном растворе силиката калия было изучено Брэди, Брауном и Хаффом [55], использовавшими метод рассеяния света. Молярное отношение 5102 Ыа20 составляло 3,8 1, и в свежеприготовленных разбавленных растворах среднемассовая молекулярная масса 5102 составляла 2000. При добавлении нейтральных солей молекулярная масса кремнезема возрастала пропорционально четвертой степени концентрации соли и обратно пропорционально корню квадратному из концентрацип кремнезема. В щелочном растворе молекулярная масса изме- [c.185]
Благодаря процессу деполимеризации, происходящему в результате разбавления раствора силиката, содержание коллоидных частиц или полисиликатных разновидностей уменьшалось примерно от 70 % при концентрации кремнезема 400 г/л до 45 % при 100 г/л 5102. С другой стороны, нагревание раствора при данной высокой концентрации и последующее его охлаждение влияли очень мало или же вовсе не давали какого-либо постоянного эффекта, так как равновесное состояние системы повторно устанавливалось при 30°С лишь в теченпе нескольких часов, к такому выводу пришел также О Коннор [65], который выполнил аналогичные эксперименты с концентрированными силикатными растворами, имевшими различные отношения 5102 К а20. Так, ои нашел, что растворы с отношениями 5102 Na20 в интервале 0,5—2,4 содержат только незначительное количество полисиликат-ионов. Но содержание полисилн-катных (или коллоидных) разновидностей заметно повышается по мере возрастания отношения 5102 Ка20 от 2,4 до 2,8 и еще выше. О Коннор предлагает уравнение скорости рассматриваемой реакции, устанавливающее взаимосвязь между константой скорости реакции с молибденовой кислотой и молекулярными массами ионных силикатных разновидностей, определяемыми методом рассеяния света. Он показал, что распределение ионных разновидностей зависело главным образом от концентрации раствора п что равновесное состояние достигалось быстро даже в том случае, когда раствор разбавлялся от 400 г/л 5102 до 20 г/л, и в дальнейшем не изменялось в течение двух недель при 25°С. [c.189]
chem21.info
Силикаты лития
ХИМИЯ КРЕМНЕЗЕМА
Ионы лития по своему поведению в кремнеземных системах сильно отличаются от ионов натрия или калия. Напоминая до некоторой степени натрий и калий при обычной температуре, ионы лития приобретают некоторые из характерных особенностей кальция при температурах выше ~60°С. Таким образом, хотя раствор силиката лития и может быть приготовлен растворением аморфного кремнезема в LiOH при 20—40°С, но при нагревании такого раствора до более высоких температур из него будет снова выделяться силикат лития. Этот эффект обратим; удивительно видеть, как раствор при нагревании затвердевает, образуя белую массу, но затем при охлаждении до 25°С в течение нескольких часов снова разжижается до однородного прозрачного состояния.
Одвей [57] в 1907 г. исследовал свойства силиката лития с молярным отношением Si02 : Li20 в интервале от 1:1 до 2,3 : 1 и отметил своеобразную обратимую нерастворимость при нагревании и охлаждении раствора. Даже и в 1952 г. Вейл [1] считал, что возможные значения концентраций и области составов силиката лития по сравнению с силикатом натрия гораздо более ограниченны. В 1969 г. Уэлдиз и Ланге [19] обобщили данные по свойствам имеющихся водных систем силиката лития.
Вероятно, только с 1950 г. был признан тот факт, что устойчивые растворы силикатов и полисиликатов лития можно готовить с любым желаемым отношением Si02 : Li20 и что такие растворы обладают полезными свойствами.
Различие между натрием и литием особенно явно проявляется для концентрированных растворов силикатов лития с молярными соотношениями Si02: Li20 от 4:1 до 15 : 1 и выше. Такие растворы силиката лития прозрачны и вполне устойчивы при 25°С, хотя большинство аналогичных составов силиката натрия, как обсуждалось выше, либо превращается в гель, либо кристаллизуется. К тому же свойства концентрированных золей коллоидного кремнезема в литиевых системах заметно отличаются от свойств золей, стабилизированных щелочью NaOH. Особенно это наглядно проявляется на примере гораздо большей совместимости золей первого типа с органическими растворителями, способными смешиваться с водой.
Раствор силиката лития невозможно приготовить растворением соответствующего силикатного стекла. Поэтому такой раствор готовят растворением очень тонко дисперсного аморфного кремнезема в растворе LiOH при 20—50°С. Такая реакция протекает гораздо быстрее в автоклаве при 75—250°С. В результате получаются раствор Li2Si03 и осадок с высоким отношением Si02: Li20, способный растворяться в процессе старения при 20—30°С [98]. Раствор с молярным отношением 3,8 можно приготовить добавлением при перемешивании порошка кремния с размером частиц 50—70 мкм к 12 %-ному раствору Li0H-h30, из которого при поддержании температуры раствора в пределах 38—45°С будет выделяться водород. После фильтрования получается немного вязкий раствор, содержащий 19% Si02 [99]. Другой способ заключается в приготовлении катионообменной смолы в литиевой форме и пропускании через нее раствора силиката натрия. При этом будет происходить замещение ионов натрия на ионы лития [100].
Реакционноспособный кремнезем
Высокие значения удельной поверхности и скорости растворения аморфного кремнезема позволяют проводить необходимые реакции при значительно более низких температурах, чем это требуется для измельченного в порошок кристаллического кремнезема. Повышенная химическая реакционная …
Гидрофильные покрытия на кремнеземе
Для некоторых применений желательно, чтобы поверхность кремнезема или стекла смачивалась водой. Но в то же время должны отсутствовать различные характерные ионные, гидрофобные или водородные связи, которые возникают при адсорбции органических …
Наиболее ранние биологические формы
Несомненно, что наиболее древними ископаемыми остатками живых организмов являются сине-зеленые водоросли, обнаруженные в виде включений в шерте (микрокристаллическом кремнеземе), открытые Баргхорном и Тайлером [12] и в дальнейшем изученные многими исследователями …
msd.com.ua
Применение силикатов и полисиликатов лития
ХИМИЯ КРЕМНЕЗЕМА
Полисиликаты лития в основном используются как противокоррозионные покрытия, содержащие тонкодисперсный цинк, в которых кремнезем играет роль неорганического связующего вещества [109, 110]. Добавление органосиликоната улучшает водостойкость покрытия [111]. Сообщается, что подобный состав годится как связующее вещество для тормозных накладок [112]. Возможное добавление в этот состав небольшого количества эмульсии стирол-акрилового сополимера ведет к улучшению адгезии к стали [113]. Другой добавкой, способной улучшить стойкость полисиликатов к морской воде, является небольшое количество гидроксида бария [114]. Согласно Дюпре и Бумену [115], силикат бария более растворим, чем соль кальция или стронция, поэтому в растворе будет достаточное количество силикат-ионов, способных ингибировать коррозию алюминия под действием щелочи. Адгезия и способность к связыванию грунтовых лаков, обогащенных цинком, соединенных с полисиликатом лития, были улучшены замещением некоторого количества дифосфида железа или кадмия на цинк [116]. .
Некоторые трудности, встречающиеся при использовании обогащенных цинком красок, связанных с полисиликатами лития, были рассмотрены в обзоре Райта [117]. Он указал, что медленно происходящая при хранении реакция между цинком и связующим веществом в процессе старения материала вызывает ухудшение качества окончательно получаемого покрытия.
Оценивалось несколько типов растворимых силикатов, но однако лишь полисиликат лития • с отношением Si02 : Li20 ~5:1 оказался удовлетворительным при использовании цинковой пыли с размером частиц 2—3 мкм. Преимущество лития выражалось главным образом в том, что смеси оказывались более стабильными [118].
Связующие свойства полезны и для других пигментных покрытий, таких, например, как краски на основе глин [119]. Цинк-литиевые силикатные покрытия могут быть получены посредством анодного электролитического осаждения на стали [120]. Другим применением полисиликата лития является уменьшение липкости кухонной посуды [121], что обеспечивается за счет способности полисиликата лития образовывать промежуточное соединение, связывающее между собой фтор - углеводородное полимерное покрытие и металл.
Осаждение нерастворимых силикатов с высоким отношением Si02 : Li20 из горячего раствора может быть использовано для образования кремнеземистых покрытий на гидрофильных поверхностях. Так, Сэме [122] обнаружил, что обогащенные кремнеземом покрытия, обеспечивающие оптические или защитные эффекты, получаются на таких поверхностях, как стекло, при погружении поверхности стекла в раствор силиката лития с отношением Si02 : Li20 2 : 1 по мере его нагревания до 95°С. Уже через 10 с образуется окрашенная пленка, показывающая интерференцию света, толщиной порядка 0,3 мкм. Могут быть использованы растворы с отношениями Si02 : Li20 от 1,3 : 1 до 10,7 : 1.
Реакционноспособный кремнезем
Высокие значения удельной поверхности и скорости растворения аморфного кремнезема позволяют проводить необходимые реакции при значительно более низких температурах, чем это требуется для измельченного в порошок кристаллического кремнезема. Повышенная химическая реакционная …
Гидрофильные покрытия на кремнеземе
Для некоторых применений желательно, чтобы поверхность кремнезема или стекла смачивалась водой. Но в то же время должны отсутствовать различные характерные ионные, гидрофобные или водородные связи, которые возникают при адсорбции органических …
Наиболее ранние биологические формы
Несомненно, что наиболее древними ископаемыми остатками живых организмов являются сине-зеленые водоросли, обнаруженные в виде включений в шерте (микрокристаллическом кремнеземе), открытые Баргхорном и Тайлером [12] и в дальнейшем изученные многими исследователями …
msd.com.ua










