Содержание
Углерод: формула, химические свойства, характеристики
Поможем понять и полюбить химию
Начать учиться
В этой статье мы дадим характеристику углерода с точки зрения химии: узнаем, металл это или неметалл, какими свойствами он обладает, с какими веществами реагирует и где находят применение различные модификации углерода.
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен. Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Запишитесь и участвуйте в розыгрыше 8 уроков
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.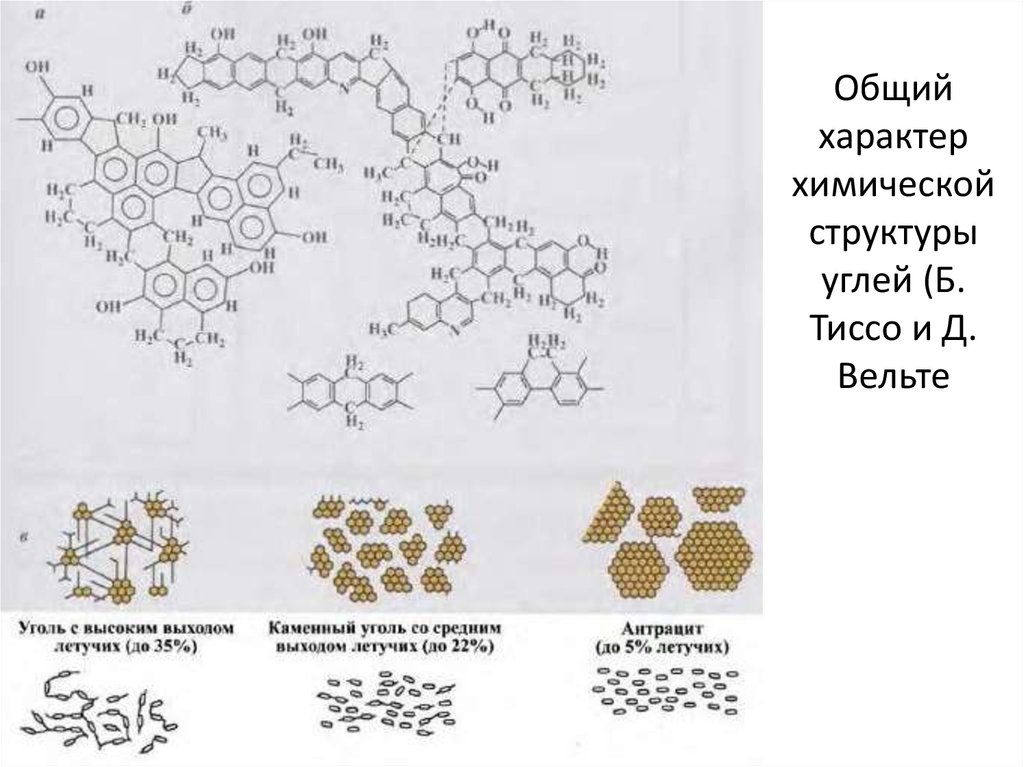
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.

Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли «Элементы», углерод занимает 11-е место по распространенности в природе. Содержание углерода составляет 0,1% массы земной коры. Свободный углерод представлен в виде алмаза и графита.
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Доля углерода в составе горючих ископаемых
Название | Содержание углерода |
|---|---|
Антрацит | 93% |
Бурые угли | 72% |
Каменные угли | 84% |
Горючие сланцы | 60% |
Нефть | 80% |
Горючие природные газы | До 99% метана |
Торф | 50% |
В атмосфере находится в виде диоксида углерода СО2 (~0,03%). В воде углерод содержится в составе растворимых гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Углерод входит в состав растений и животных (~20%).
В воде углерод содержится в составе растворимых гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Углерод входит в состав растений и животных (~20%).
Бесплатные занятия по английскому с носителем
Занимайтесь по 15 минут в день. Осваивайте английскую грамматику и лексику. Сделайте язык частью жизни.
Химические свойства углерода
Взаимодействие со фтором
Углерод обладает низкой реакционной способностью и из галогенов реагирует только со фтором:
С + 2F2 = CF4.
Взаимодействие с кислородом
При нагревании взаимодействует с кислородом, образуя оксиды СО и СО2:
2С + О2 = 2СО;
С + О2 = СО2.
Взаимодействие с другими неметаллами
Реагирует с серой:
С + 2S = CS2.
Не взаимодействует с азотом и фосфором.
Углерод взаимодействует с водородом и кремнием в присутствии никелевого катализатора:
C + Si = SiC;
C + 2H2 = CH4.
Взаимодействие с металлами
Способен взаимодействовать с металлами, образуя карбиды:
Ca + 2C = CaC2.
Взаимодействие с водой
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H2O = CO + H2.
Восстановительные свойства
Углерод способен восстанавливать многие металлы из их оксидов (карботермия):
2ZnO + C = 2Zn + CO2.
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV):
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
C + 4HNO3 = CO2 + 4NO2 + 2H2O.
Вопросы для самопроверки
Что такое углерод? Дайте характеристику его положения в Периодической системе химических элементов Д. И. Менделеева.
Как распределяются электроны по энергетическим уровням в атоме углерода? Напишите электронную конфигурацию углерода.
Углерод является окислителем в реакции с:
Кислородом
Хлором
Водородом
Серой
Возможно ли взаимопревращение алмаза и графита? Объясните почему.
В виде каких соединений углерод находится в природе?
Для какого аллотропного видоизменения углерода характерна совместимость с тканями человеческого организма?
Опишите физические свойства графена и карбина.

Для чего используют карботермию?
Чем обусловлено наличие аллотропных видоизменений углерода?
В чем заключается различие между нейтральным состоянием атома углерода и возбужденным? Какие возможны степени окисления?
Красота химии — в том, что она изучает окружающий нас мир. Но это не всегда получается увидеть на школьных занятиях. Онлайн-уроки химии в Skysmart помогут не только подтянуть оценки и подготовиться к экзаменам, но и полюбить этот предмет, тесно связанный с окружающим нас миром.
Татьяна Сосновцева
К предыдущей статье
Химия сероводорода
К следующей статье
Простые и сложные вещества
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Определение физико-химических и адсорбционных характеристик нового активированного угля из косточек урюка
Цитировать:
Определение физико-химических и адсорбционных характеристик нового активированного угля из косточек урюка // Universum: технические науки : электрон. научн. журн. Хайитов Р.Р. [и др.]. 2017. № 2 (35). URL: https://7universum.com/ru/tech/archive/item/4373 (дата обращения: 26.12.2022).
научн. журн. Хайитов Р.Р. [и др.]. 2017. № 2 (35). URL: https://7universum.com/ru/tech/archive/item/4373 (дата обращения: 26.12.2022).
Прочитать статью:
АННОТАЦИЯ
В предлагаемой статье приведены методики определения физико-химических и адсорбционных характеристик активированных углей. В процессе исследования определены физико-химические и адсорбционные характеристики полученного нами нового активированного угля из косточек урюка. С целью импортозамещения его характеристики сравнивались с известным промышленным активированным углем марки АГ-3.
ABSTRACT
In the article methods for determining physical-chemical and adsorptive characteristics of activated carbons are presented. During the research process physical-chemical and adsorptive characteristics of the obtained new activated carbon from kernels of the dried apricot are identified. In order to import new activated carbon, its characteristics are compared with the known industrial activated carbon AG-3.
Введение
Для разделения и очистки газов, рекуперации летучих органических растворителей, очистки и осветления растворов могут быть использованы различные мелкопористые сорбенты – силикагель, природные и синтетические цеолиты, алюмогели, пористые стекла, иониты. Однако только активированные угли (АУ) в полной мере отвечают требованиям, предъявляемым к твердому поглотителю [7; 8].
Производство АУ неуклонно возрастает, а области их применения непрерывно расширяются. Традиционным сырьем для производства АУ являются древесина, торф, торфяной кокс, некоторые каменные угли и полукоксы на их основе. В Узбекистане, несмотря на большой спрос на АУ, их не производят из-за отсутствия промышленных установок. Наряду с этим на пищевых предприятиях республики ежегодно образуются значительные массы отходов переработки плодов урюка, повсеместно возделываемого на территории Республики. Согласно мировой практике названный отход может служить хорошим сырьем для получения активированного угля. Существует достаточно подробная информация о переработке ядра фруктовых косточек в ценные продукты [8], но литературные данные по получению и применению угольных сорбентов на основе скорлупы косточек немногочисленны [1; 8].
Существует достаточно подробная информация о переработке ядра фруктовых косточек в ценные продукты [8], но литературные данные по получению и применению угольных сорбентов на основе скорлупы косточек немногочисленны [1; 8].
На территории Узбекистане расположены четыре основных газоперерабатывающих завода: ООО «Мубарекский газоперерабатывающий завод», ООО «Шуртаннефтегаз», Шуртанский и Устюртский газохимические комплексы. На установках аминовой очистки природного газа от кислых компонентов вышеперечисленных заводов для адсорбционной очистки регенерированных аминовых растворов применяются активированные угли марки АГ-3, HX-30, Шемверон и др. Необходимо учитывать, что применяемые активированные угли являются зарубежного происхождения и импортируется за валюты. С целью импортозамещения нами был получен активированный уголь из косточек урюка (АУ-КУ).
Целью предлагаемой работы стало определение и изучение физико-химических и адсорбционных свойств нового АУ-КУ в сравнении с промышленными образцами при очистке регенерированного аминового раствора.
Методики экспериментов
В ходе работы использован комплекс современных и классических методов исследования [2-6], позволяющие определить физико-химические и адсорбционные характеристики активированных углей, в частности, криоскопический метод определения динамической емкости сорбентов (разработка ИОНХ АН РУз) [9].
Криоскопический метод определения динамической емкости сорбентов
Адсорбционная емкость АУ-КУ по бензолу определялась с помощью криоскопического метода [9].
Сущность определения селективности и динамической емкости адсорбентов криоскопическим методом заключается в изменении концентрации эталонного раствора, хроматографируемого через адсорбент, и определяется согласно изменению депрессии температуры кристаллизации раствора.
Анализ осуществляется следующим образом: 2 %-ный эталонный раствор органического вещества в циклогексане пропускается в стеклянной колонке через 10 г адсорбента (фр. 0,25-0,50 мм, предварительно дегидратированного) до его полного насыщения, то есть когда температура кристаллизации фильтрата (t3) не станет равной температуре кристаллизации исходного эталонного раствора (t2). Скорость истечения фильтрата – 1 капля в 1 секунду, что соответствует 0,4 объема в час. Так как температура кристаллизации исходного циклогексана (t1) и эталонного раствора (t2) определяется заранее, то весь анализ сводится к определению температуры кристаллизации фильтрата (t3). Фильтрат отбирается по объему порциями 12,85 мл (что соответствует 10 г). В каждой порции определяется температура кристаллизации (t3), а затем вычисляется количество адсорбированного вещества (мол. %) по формуле:
0,25-0,50 мм, предварительно дегидратированного) до его полного насыщения, то есть когда температура кристаллизации фильтрата (t3) не станет равной температуре кристаллизации исходного эталонного раствора (t2). Скорость истечения фильтрата – 1 капля в 1 секунду, что соответствует 0,4 объема в час. Так как температура кристаллизации исходного циклогексана (t1) и эталонного раствора (t2) определяется заранее, то весь анализ сводится к определению температуры кристаллизации фильтрата (t3). Фильтрат отбирается по объему порциями 12,85 мл (что соответствует 10 г). В каждой порции определяется температура кристаллизации (t3), а затем вычисляется количество адсорбированного вещества (мол. %) по формуле:
(1)
Мольные проценты адсорбированного вещества можно пересчитать в весовых процентах по следующей формуле:
(2)
где М – молекулярная масса вещества;
84,16 – молекулярная масса циклогексана.
Количество адсорбированного вещества в весовых процентах для каждой порции фильтрата пересчитываются на граммы, суммируются и относятся к 100 г адсорбента.
Данный метод удобен в оперировании, быстр и точен. Он предусматривает использование циклогексана как растворителя высокой степени чистоты для приготовления модельных (эталонных) растворов сорбатов.
Результаты и их обсуждение
Путем карбонизации и активации косточек урюка получен активированный уголь. Для каждого процесса определены его физико-химические и адсорбционные характеристики. Полученные результаты приведены в таблицах 1 и 2.
Таблица 1.
Результаты карбонизации, физико-химические и адсорбционные характеристики урюковых косточек
|
Темпера
тура процесса,
°С
|
Скорость подъема температуры, °С/мин.
|
Вес сырья, г
|
Вес карбони
зата, г
|
Насыпная плотность, г/дм3
|
Удельная поверхность, м2/г
|
Зольность, %
|
Адсорбционная активность
по C6H6,
г/100 г
|
|
400
|
7-10
|
1000
|
613
|
524
|
211
|
4,8
|
0,24
|
|
500
|
7-10
|
1000
|
521
|
557
|
225
|
5,0
|
0,46
|
|
600
|
7-10
|
1000
|
405
|
562
|
234
|
5,1
|
0,52
|
|
700
|
7-10
|
1000
|
276
|
596
|
475
|
5,2
|
0,87
|
|
800
|
7-10
|
1000
|
253
|
623
|
513
|
5,5
|
1,18
|
Полученный карбонизат косточкового сырья активирован водяным паром. Условия и результаты активации показаны в таблице 2.
Условия и результаты активации показаны в таблице 2.
Таблица 2.
Результаты активации, физико-химические и адсорбционные характеристики урюкового карбонизата
|
Температура процесса,
°С
|
Время выдержки, мин.
|
Степень обгара, %
|
Насыпная плотность, г/дм3
|
Удельная поверхность, м2/г
|
Зольность, %
|
Адсорбционная активность по C6H6, г/100 г
|
|
800
|
60
|
29
|
577
|
805
|
10,6
|
1,45
|
|
850
|
120
|
27
|
570
|
890
|
9,5
|
1,87
|
Полученные экспериментальные результаты, приведенные в таблице 1, позволили констатировать, что оптимальными условиями карбонизации косточек урюков являются продолжительность процесса 1 час при температуре 800 °С.
На основе полученных данных (таблица 2) установлено, что оптимальные условия активации карбонизатов косточкового сырья – температура 850 °C и продолжительность процесса – 2 часа.
В ходе работы провели сравнение некоторых характеристик полученного нами активированного угля АУ-КУ с известным промышленным активированным углем марки АГ-3 (таблица 3).
Таблица 3.
Некоторые сравнительные характеристики активированных углей
|
Наименование показателей
|
Активированные угли
| |
|
АГ-3
|
АУ-КУ
| |
|
Насыпная плотность, г/дм3
|
450
|
800-890
|
|
Суммарный объем пор, см3/г
|
0,8-1,0
|
0,87-1,03
|
|
Объем микропор, см3/г
|
0,24-0,28
|
0,30-0,35
|
|
Адсорбционная активность по C6H6, г/100 г
|
1,23
|
1,87
|
|
Статическая активность по йоду, %
|
43
|
43-45
|
|
Прочность на истирание, %
|
75
|
75-78
|
|
Зольность, %
|
14-16
|
9-10
|
Проведенные исследования позволяют рекомендовать применение активированного угля АУ-КУ для очистки регенерированного аминового раствора.
Заключение
Проанализировав и сопоставив литературные данные, установлено, что полученный целевой продукт по адсорбционной активности находится на уровне активированного угля из косточкового сырья, являясь одним из самых качественных мировых активированных промышленных углей, и значительно превосходит многие другие углеродные адсорбенты (таблица 3). Таким образом, проведенные исследования демонстрируют целесообразность переработки охарактеризованных отходов Республики Узбекистан на углеродные адсорбенты.
Оценена перспектива переработки отходов в виде косточек урюка, образующихся на предприятиях пищевой промышленности Республики Узбекистан, на активированные угли.
Список литературы:
1. Бутырин Г.М. Высокопористые углеродные материалы. – М.: Химия, 1976. – С. 187.
2. ГОСТ 12596-67. Угли активные: Метод определения массовой доли золы. – М.: ИПК Изд-во стандартов, 2003. – 4 с.
– 4 с.
3. ГОСТ 17219-71. Угли активные: Метод определения суммарного объема пор по воде. – М., 1988. – 4 с.
4. ГОСТ 6217-74. Уголь активный древесный дробленый: Технические условия. – М.: ИПК Изд-во стандартов, 2003. – 8 с.
5. ГОСТ 16188-70. Сорбенты: Метод определения прочности при истирании. – М., 1970. – 5 с.
6. ГОСТ 16189-70. Сорбенты: Метод сокращения и усреднения проб. – М., 1970. – 4 с.
7. Кельцев Н.В. Основы адсорбционной техники. – М.: Химия, 1984. – 115 с.
8. Кинле Х., Бадер Э. Активные угли и их промышленное применение / пер. с нем. – Л.: Химия, 1984. – C. 215.
9. Рябова Н.Д. Адсорбенты для светлых нефтепродуктов. – Ташкент: ФАН, 1975. –144 с.
Углерод | Факты, использование и свойства
углерод
Посмотреть все СМИ
- Ключевые люди:
- Август Кекуле фон Страдониц
Сэр Гарольд В. Крото
Роберт Керл
Джон Ульрик Неф
Чарльз Гловер Баркла
- Похожие темы:
- фуллерен
графен
алмаз
графит
аморфный углерод
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
углерод (C) , неметаллический химический элемент в группе 14 (IVa) периодической таблицы. Хотя углерод широко распространен в природе, его не так много — он составляет всего около 0,025 процента земной коры, — однако он образует больше соединений, чем все остальные элементы вместе взятые. В 1961 году изотоп углерода-12 был выбран вместо кислорода в качестве эталона, относительно которого измеряется атомный вес всех других элементов. Углерод-14, который является радиоактивным, является изотопом, используемым для радиоуглеродного датирования и радиоактивной маркировки.
Хотя углерод широко распространен в природе, его не так много — он составляет всего около 0,025 процента земной коры, — однако он образует больше соединений, чем все остальные элементы вместе взятые. В 1961 году изотоп углерода-12 был выбран вместо кислорода в качестве эталона, относительно которого измеряется атомный вес всех других элементов. Углерод-14, который является радиоактивным, является изотопом, используемым для радиоуглеродного датирования и радиоактивной маркировки.
| atomic number | 6 |
|---|---|
| atomic weight | 12.0096 to 12.0116 |
| melting point | 3,550 °C (6,420 °F) |
| boiling point | 4,827 °C (8,721 °F) |
| density | |
| diamond | 3.52 g/cm 3 |
| graphite | 2. 25 g/cm 3 25 g/cm 3 |
| amorphous | 1.9 g/cm 3 |
| oxidation states | +2, +3, +4 |
| electron configuration | 1 s 2 2 s 2 2 p 2 |
Свойства и применение
По весу углерод занимает 19-е место по распространенности элементов в земной коре, и, по оценкам, количество атомов углерода в 5 раз превышает 3. как атомы кремния во Вселенной. Только водорода, гелия, кислорода, неона и азота атомарно больше в космосе, чем углерода. Углерод — это космический продукт «сгорания» гелия, при котором три ядра гелия с атомным весом 4 сливаются, образуя ядро углерода с атомным весом 12,9.0003
Знать об углероде и почему его называют элементом жизни
Посмотреть все видео к этой статье
В земной коре элементарный углерод является второстепенным компонентом. Однако соединения углерода (то есть карбонаты магния и кальция) образуют обычные минералы (например, магнезит, доломит, мрамор или известняк). Кораллы и раковины устриц и моллюсков в основном состоят из карбоната кальция. Углерод широко распространен в виде угля и органических соединений, составляющих нефть, природный газ и все ткани растений и животных. Естественная последовательность химических реакций, называемая углеродным циклом, включающая превращение атмосферного углекислого газа в углеводы путем фотосинтеза в растениях, потребление этих углеводов животными и их окисление посредством метаболизма с образованием двуокиси углерода и других продуктов, а также возврат углерода. двуокиси в атмосферу — один из важнейших биологических процессов.
Однако соединения углерода (то есть карбонаты магния и кальция) образуют обычные минералы (например, магнезит, доломит, мрамор или известняк). Кораллы и раковины устриц и моллюсков в основном состоят из карбоната кальция. Углерод широко распространен в виде угля и органических соединений, составляющих нефть, природный газ и все ткани растений и животных. Естественная последовательность химических реакций, называемая углеродным циклом, включающая превращение атмосферного углекислого газа в углеводы путем фотосинтеза в растениях, потребление этих углеводов животными и их окисление посредством метаболизма с образованием двуокиси углерода и других продуктов, а также возврат углерода. двуокиси в атмосферу — один из важнейших биологических процессов.
Углерод как элемент был открыт первым человеком, который достал древесный уголь из огня. Таким образом, наряду с серой, железом, оловом, свинцом, медью, ртутью, серебром и золотом углерод был одним из небольшой группы элементов, хорошо известных в древнем мире. Современная углеродная химия восходит к разработке углей, нефти и природного газа в качестве топлива и к выяснению синтетической органической химии, которые существенно развились с 1800-х годов.
Современная углеродная химия восходит к разработке углей, нефти и природного газа в качестве топлива и к выяснению синтетической органической химии, которые существенно развились с 1800-х годов.
Элементарный углерод существует в нескольких формах, каждая из которых имеет свои физические характеристики. Две его четко определенные формы, алмаз и графит, имеют кристаллическую структуру, но различаются по физическим свойствам, поскольку расположение атомов в их структурах неодинаково. Третья форма, называемая фуллереном, состоит из множества молекул, полностью состоящих из углерода. Сфероидальные фуллерены с закрытой клеткой называются бакерминстерфуллеренами, или «бакиболами», а цилиндрические фуллерены называются нанотрубками. Четвертая форма, называемая Q-углеродом, является кристаллической и магнитной. Еще одна форма, называемая аморфным углеродом, не имеет кристаллической структуры. Другие формы — сажа, древесный уголь, ламповая сажа, уголь, кокс — иногда называют аморфными, но рентгенологическое исследование показало, что эти вещества действительно обладают низкой степенью кристалличности. Алмаз и графит встречаются на Земле в природе, но их также можно производить синтетическим путем; они химически инертны, но соединяются с кислородом при высоких температурах, как это делает аморфный углерод. Фуллерен был случайно открыт в 1985 в качестве синтетического продукта в ходе лабораторных экспериментов по моделированию химии атмосферы звезд-гигантов. Позже было обнаружено, что он встречается в природе в крошечных количествах на Земле и в метеоритах. Q-углерод также является синтетическим, но ученые предполагают, что он может образовываться в горячих средах некоторых планетарных ядер.
Алмаз и графит встречаются на Земле в природе, но их также можно производить синтетическим путем; они химически инертны, но соединяются с кислородом при высоких температурах, как это делает аморфный углерод. Фуллерен был случайно открыт в 1985 в качестве синтетического продукта в ходе лабораторных экспериментов по моделированию химии атмосферы звезд-гигантов. Позже было обнаружено, что он встречается в природе в крошечных количествах на Земле и в метеоритах. Q-углерод также является синтетическим, но ученые предполагают, что он может образовываться в горячих средах некоторых планетарных ядер.
Слово углерод , вероятно, происходит от латинского карбо , означающего по-разному «уголь», «древесный уголь», «угли». Срок бриллиант , искаженное греческое слово adamas , «непобедимый», точно описывает постоянство этой кристаллизованной формы углерода, точно так же, как графит , название другой кристаллической формы углерода, происходящее от греческого глагола . графеин , «писать», отражает его свойство оставлять темный след при трении о поверхность. До открытия в 1779 году, что графит при сгорании на воздухе образует углекислый газ, графит путали как с металлическим свинцом, так и с внешне похожим веществом, минералом молибденитом.
графеин , «писать», отражает его свойство оставлять темный след при трении о поверхность. До открытия в 1779 году, что графит при сгорании на воздухе образует углекислый газ, графит путали как с металлическим свинцом, так и с внешне похожим веществом, минералом молибденитом.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Чистый алмаз является самым твердым известным природным веществом и плохим проводником электричества. Графит, с другой стороны, представляет собой мягкое скользкое твердое вещество, которое является хорошим проводником как тепла, так и электричества. Углерод, как и алмаз, является самым дорогим и блестящим из всех природных драгоценных камней и самым твердым из встречающихся в природе абразивов. Графит используется в качестве смазки. В микрокристаллическом и почти аморфном виде используется как черный пигмент, как адсорбент, как горючее, как наполнитель для каучука, а в смеси с глиной — как «грифель» карандашей. Поскольку он проводит электричество, но не плавится, графит также используется для электродов в электрических печах и сухих камерах, а также для изготовления тиглей, в которых плавятся металлы. Молекулы фуллерена перспективны в ряде приложений, включая материалы с высокой прочностью на растяжение, уникальные электронные устройства и устройства хранения энергии, а также безопасную герметизацию горючих газов, таких как водород. Q-углерод, который создается путем быстрого охлаждения образца элементарного углерода, температура которого была повышена до 4000 К (3727 °C [6740 °F]), тверже алмаза, и его можно использовать для изготовления алмазных структур (таких как в виде алмазных пленок и микроигл) внутри его матрицы. Элементарный углерод нетоксичен.
Поскольку он проводит электричество, но не плавится, графит также используется для электродов в электрических печах и сухих камерах, а также для изготовления тиглей, в которых плавятся металлы. Молекулы фуллерена перспективны в ряде приложений, включая материалы с высокой прочностью на растяжение, уникальные электронные устройства и устройства хранения энергии, а также безопасную герметизацию горючих газов, таких как водород. Q-углерод, который создается путем быстрого охлаждения образца элементарного углерода, температура которого была повышена до 4000 К (3727 °C [6740 °F]), тверже алмаза, и его можно использовать для изготовления алмазных структур (таких как в виде алмазных пленок и микроигл) внутри его матрицы. Элементарный углерод нетоксичен.
Каждая из «аморфных» форм углерода имеет свою специфику и, следовательно, каждая из них имеет свое особое применение. Все они являются продуктами окисления и других форм разложения органических соединений. Уголь и кокс, например, широко используются в качестве топлива. Древесный уголь используется в качестве абсорбирующего и фильтрующего агента, а также в качестве топлива, а когда-то широко использовался в качестве ингредиента пороха. (Угли представляют собой элементарный углерод, смешанный с различным количеством углеродных соединений. Кокс и древесный уголь представляют собой почти чистый углерод.) Помимо использования в производстве чернил и красок, технический углерод добавляется в резину, используемую в шинах, для улучшения ее износостойкости. Костяная сажа или древесный уголь животных может поглощать газы и красящие вещества из многих других материалов.
Древесный уголь используется в качестве абсорбирующего и фильтрующего агента, а также в качестве топлива, а когда-то широко использовался в качестве ингредиента пороха. (Угли представляют собой элементарный углерод, смешанный с различным количеством углеродных соединений. Кокс и древесный уголь представляют собой почти чистый углерод.) Помимо использования в производстве чернил и красок, технический углерод добавляется в резину, используемую в шинах, для улучшения ее износостойкости. Костяная сажа или древесный уголь животных может поглощать газы и красящие вещества из многих других материалов.
Углерод, элементарный или связанный, обычно определяют количественно путем преобразования в газообразный диоксид углерода, который затем может поглощаться другими химическими веществами с получением либо взвешиваемого продукта, либо раствора с кислотными свойствами, который можно титровать.
Производство элементарного углерода
До 1955 года все алмазы добывались из природных месторождений, наиболее значительных на юге Африки, но встречающихся также в Бразилии, Венесуэле, Гайане и Сибири. Единственный известный источник в США, в Арканзасе, не имеет коммерческого значения; и Индия, которая когда-то была источником чистых алмазов, в настоящее время не является важным поставщиком. Первичным источником алмазов является мягкая голубоватая перидотическая порода, называемая кимберлитом (в честь знаменитого месторождения Кимберли, Южная Африка), обнаруженная в вулканических структурах, называемых трубками, но многие алмазы встречаются в аллювиальных отложениях, предположительно образовавшихся в результате выветривания первичных источников. Единичные находки по всему миру в регионах, где не указаны источники, не были редкостью.
Единственный известный источник в США, в Арканзасе, не имеет коммерческого значения; и Индия, которая когда-то была источником чистых алмазов, в настоящее время не является важным поставщиком. Первичным источником алмазов является мягкая голубоватая перидотическая порода, называемая кимберлитом (в честь знаменитого месторождения Кимберли, Южная Африка), обнаруженная в вулканических структурах, называемых трубками, но многие алмазы встречаются в аллювиальных отложениях, предположительно образовавшихся в результате выветривания первичных источников. Единичные находки по всему миру в регионах, где не указаны источники, не были редкостью.
Природные месторождения разрабатываются дроблением, гравитационной и флотационной сепарацией и удалением алмазов путем прилипания их к слою смазки на подходящем столе. В результате получаются следующие продукты: (1) собственно алмаз — деформированные кубические кристаллические камни ювелирного качества, варьирующиеся от бесцветных до красных, розовых, голубых, зеленых или желтых; (2) борт — мельчайшие темные кристаллы абразивного, но не ювелирного качества; 3) баллас – беспорядочно ориентированные кристаллы абразивного качества; 4) маклеры — треугольные подушкообразные кристаллы, используемые в промышленности; 5) карбонадо – смешанные алмазно-графитовые кристаллиты, содержащие другие примеси.
Успешное преобразование графита в алмаз в лаборатории было осуществлено в 1955 году. Процедура включала одновременное использование чрезвычайно высокого давления и температуры с железом в качестве растворителя или катализатора. Впоследствии железо заменили хромом, марганцем, кобальтом, никелем и танталом. Синтетические алмазы в настоящее время производятся в нескольких странах и все чаще используются вместо природных материалов в качестве промышленных абразивов.
Графит встречается в природе во многих областях, наиболее важные месторождения находятся в Китае, Индии, Бразилии, Турции, Мексике, Канаде, России и на Мадагаскаре. Используются методы как поверхностной, так и глубокой добычи с последующей флотацией, но основная часть товарного графита производится путем нагревания нефтяного кокса в электропечах. Лучше кристаллизованная форма, известная как пиролитический графит, получается при разложении низкомолекулярных углеводородов при нагревании. Графитовые волокна значительной прочности на разрыв получают путем карбонизации натуральных и синтетических органических волокон.
Углеродные продукты получают нагреванием угля (для получения кокса), природного газа (для получения сажи) или углеродсодержащего материала растительного или животного происхождения, такого как древесина или кость (для получения древесного угля), при повышенных температурах в присутствии недостаточно кислорода для горения. Летучие побочные продукты выделяют и используют отдельно.
Наука о том, что делает уголь таким грязным
Миру не терпится избавиться от потребности в угле. Без резкого сокращения использования угля мало шансов достичь целей по выбросам парниковых газов и избежать наиболее катастрофических последствий изменения климата.
Устранение этого вещества связано не только с парниковыми газами: добыча угля и его последующее сжигание производят другие токсины, загрязняющие наш воздух, воду и почву.
Реклама
Что делает уголь таким грязным? Чтобы понять, нам придется надеть лабораторные халаты и немного заняться химией.
Парниковая арифметика
Проблема парниковых газов относительно легко понять. Все ископаемые виды топлива состоят в основном из углерода и водорода. При сгорании углерод превращается в углекислый газ, а водород в воду. Каждая из этих реакций выделяет немного разное количество тепла.
C + O 2 → CO 2 генерирует 393 кДж тепла
H 2 + 0,5 O 2 → H 2 O 2 → H 2 O 2 → H 2 O . Больше всего нас беспокоит углекислый газ, парниковый газ, который удерживает солнечное тепло в нашей атмосфере. Это означает, что лучшее ископаемое топливо — то, которое производит наименьшее количество выбросов CO 2 для производства такого же количества тепла, — это то, которое содержит много атомов водорода на каждый атом углерода.
Природный газ побеждает в этой битве. Он содержит в основном метан, простой химикат с формулой CH 4 . Это означает, что на каждый атом углерода приходится четыре атома водорода — максимум, который может вместить один атом углерода.
Это означает, что на каждый атом углерода приходится четыре атома водорода — максимум, который может вместить один атом углерода.
Химическая формула угля гораздо сложнее (как мы увидим позже). Это потому, что, в отличие от природного газа, уголь представляет собой смесь многих тысяч видов химических веществ. Но чтобы понять его тепловыделение, мы можем упростить формулу угля до CH (это один атом водорода на каждый атом углерода).
В результате уголь производит в два раза больше углекислого газа на единицу тепловой энергии по сравнению с природным газом.
Рекламное объявление
Заболоченное начало
Помимо вклада парниковых газов в изменение климата, у угля есть и другие проблемы. Это связано с тем, как материал был сформирован.
«Уголь — самое сложное твердое вещество, которое мы когда-либо находили и анализировали, — говорит Джонатан Мэтьюз, ученый-угольщик из Пенсильванского университета.
Много миллионов лет назад какое-то природное явление — может быть, наводнение, может быть, тайфун — похоронило под водой обширные леса. По мере того как новые слои почвы откладывались поверх деревьев, лишая их воздуха, погребенная древесина постепенно превращалась в торфяные болота. Накоплялось все больше и больше слоев отложений, повышая давление и температуру под ними, пока, наконец, болото не превратилось в уголь.
По мере того как новые слои почвы откладывались поверх деревьев, лишая их воздуха, погребенная древесина постепенно превращалась в торфяные болота. Накоплялось все больше и больше слоев отложений, повышая давление и температуру под ними, пока, наконец, болото не превратилось в уголь.
Насчет «многих миллионов» я намеренно неточен, потому что угольные месторождения в разных регионах могут иметь разный возраст. Уголь в США образовался в каменноугольный период, который длился от 360 до 300 миллионов лет назад. С другой стороны, австралийский уголь образовался в пермский период, между 300 и 250 миллионами лет назад.
Реклама
Поскольку уголь изначально образовался из растений, он содержит в основном углерод, водород, кислород и азот. Уголь помог создать основанную на углероде отрасль химии, которую мы называем «органической химией». При нагревании угля в отсутствие воздуха его сложная смесь распадается на более простые формы. Эти химические вещества, такие как бензол, толуол, нафталин, антрацен и фенол, составляют основу духов, взрывчатых веществ и лекарств.
Растения также содержат целый ряд других элементов из таблицы Менделеева в гораздо меньших количествах. Важно отметить, что во время своего образования уголь может поглощать и другие элементы, содержащиеся в окружающих его грязевых отложениях или загрязненной воде. В зависимости от геологии региона типы и количества этих элементов различаются; более половины элементов таблицы Менделеева обнаружено в разных типах углей.
«Процесс образования угля усугубляет его сложность», — говорит Мэтьюз. «Вот почему почти каждый найденный кусок угля химически уникален».
При сжигании угля многие из этих элементов выбрасываются в атмосферу вместе с другими газами. Они могут путешествовать на многие мили, прежде чем приземлятся на растения или в почву, где они могут впитаться в деревья или урожай и в конечном итоге быть съеденными людьми. Некоторые из этих элементов также могут попасть в легкие человека, где ядовитые элементы, такие как олово, кадмий и ртуть, могут нанести реальный вред нервной, пищеварительной и иммунной системам.
Реклама
Несмотря на правила угольной промышленности, эти металлы часто попадают в окружающую среду. Более 40% всех выбросов ртути в США по-прежнему приходится на угольные электростанции. В 2014 году только в США в результате деятельности, связанной с углем, также было выброшено 40 метрических тонн свинца, 30 тонн мышьяка и 4 тонны кадмия.
Конец дыма
Однако все эти химические загрязнители составляют лишь часть проблемы. Наиболее заметным проявлением воздействия угля на окружающую среду является смог: результат химической реакции горения угля. Поскольку уголь представляет собой сложную смесь химических веществ, он не горит так чисто, как природный газ — не весь углерод и водород аккуратно преобразуются в углекислый газ и воду. Вместо этого угольный дым содержит несгоревшие или полусгоревшие частицы углерода, оксиды серы, оксиды азота и множество сложных органических молекул, образующихся в процессе горения.
У каждого из них свой способ причинения вреда. Возьмем их по одному.
Возьмем их по одному.
Объявление
Сажа: Несгоревшие или полусгоревшие частицы угля можно отнести к категории сажи. Его внешний вид (и в значительной степени его химический состав) похож на сажу в дымоходах каминов: мелкий черный порошок. Сажа, которая может нести любое количество перечисленных выше загрязнителей, вредна для легких. Но он еще более опасен, потому что он достаточно мал, чтобы попасть в кровоток при вдыхании. Это может даже закончиться в мозгу. Уголь и другое твердое топливо, используемое в домах, является основной причиной смерти от загрязнения воздуха в Индии. Известно, что в Индии сажа покрывает ледники, делая их темнее, чтобы удерживать больше солнечного тепла и быстрее таять.
Оксид серы: При высоких температурах внутри печи сера в угле и кислород в воздухе объединяются с образованием оксида серы, который вызывает раздражение при вдыхании. Когда он соединяется с водой, он образует серную кислоту, создавая кислотные дожди. В 1960-х и 1970-х годах серные дожди были обычным явлением в США и других странах. С тех пор на большинстве электростанций было установлено оборудование, которое вытягивает выбросы серы из дымовых труб, но некоторое количество серы все же попадает в атмосферу.
В 1960-х и 1970-х годах серные дожди были обычным явлением в США и других странах. С тех пор на большинстве электростанций было установлено оборудование, которое вытягивает выбросы серы из дымовых труб, но некоторое количество серы все же попадает в атмосферу.
Оксиды азота: Как и сера, азот в угле соединяется с кислородом воздуха, образуя смесь оксидов азота. Они являются раздражителями и могут вызывать респираторные заболевания, такие как пневмония. Оксиды азота также химически активны, что означает, что они смешиваются с другими загрязняющими веществами в атмосфере, создавая новые, такие как озон.
Летучие органические соединения (ЛОС): При добыче и сжигании угля выделяются вредные соединения на основе углерода, которые сохраняются в атмосфере в виде газов. Это то, с чем оксиды азота могут реагировать с образованием озона и других загрязняющих веществ. Эти химические вещества вредны для человека, других животных и растений.
Реклама
Угарный газ: Иногда вместо того, чтобы углерод соединяется с кислородом с образованием двуокиси углерода, он вступает в реакцию с образованием угарного газа — ядовитого газа.
За прошедшие годы правила работы угольных электростанций помогли сократить выбросы некоторых из этих загрязняющих веществ. Однако индийские угольные электростанции серьезно отстают. В 2015 году правительство установило крайний срок на 2017 год для электростанций, чтобы установить оборудование, которое сократит выбросы серы и азота. Немногие электростанции уложились в срок, поэтому теперь правительство продлило его до 2022 года. Эта задержка, вероятно, приведет к преждевременной смерти не менее 26 000 человек и потере многих миллионов рабочих дней в год.
Более развитые страны уже установили эти скрубберы, а некоторые из них даже сделали еще один шаг вперед. Две угольные электростанции, одна в Канаде и одна в США, в настоящее время улавливают большую часть производимого ими углекислого газа. В обоих случаях уловленный углекислый газ закачивается в землю для извлечения нефти. Как только технология станет достаточно дешевой, производители смогут просто закапывать углекислый газ под землю, не субсидируя процесс за счет продажи нефти.



