Содержание
Кремний. Химия кремния и его соединений
1. Положение кремния в периодической системе химических элементов
2. Электронное строение кремния
3. Физические свойства и нахождение в природе кремния
4. Качественные реакции на силикаты
5. Основные соединения кремния
6. Способы получения кремния
7. Химические свойства кремния
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и углеродом
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с щелочами
7.2.2. Взаимодействие с кислотами
7.2.3. Взаимодействие с азотной кислотой
Бинарные соединения кремния — силициды, силан и др.
Оксид кремния (IV)
1. Физические свойства и нахождение в природе
2. Химические свойства
2. 1. Взаимодействие с щелочами и основными оксидами
1. Взаимодействие с щелочами и основными оксидами
2.2. Взаимодействие с водой
2.3. Взаимодействие с карбонатами
2.4. Взаимодействие с кислотами
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
Кремниевая кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
Силикаты
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии:
+14Si 1s22s22p63s23p2
Электронная конфигурация кремния в возбужденном состоянии:
+14Si* 1s22s22p63s13p3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO32- — взаимодействие солей-силикатов с сильными кислотами. Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например, если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 кремниевая кислота H2SiO3 силикаты MeSiO3 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г.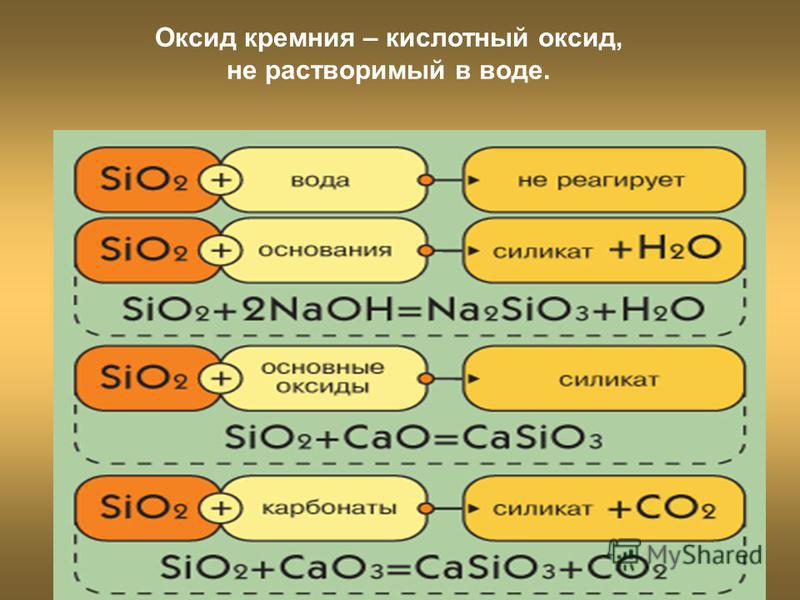 Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
3SiO2 + 4Al → 3Si + 2Al2O3
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком:
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана:
SiH4 → Si + 2H2
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами, и с неметаллами.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
При нагревании кремний реагирует с хлором, бромом, йодом:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
1.2. При сильном нагревании (около 2000оС) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом.
1.4. С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2 → Si3N4
1. 5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 → SiO2
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Видеоопыт взаимодействия кремния с раствором щелочи можно посмотреть здесь.
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
При обработке кремния безводным фтороводородом комплекс не образуется:
Si(тв. ) + 4HF(г.) = SiF4 + 2H2
) + 4HF(г.) = SiF4 + 2H2
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например, силицид магния разлагается водой на гидроксид магния и силан:
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4
Соляная кислота легко разлагает силицид магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg2Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
SiH4 + 2O2 → SiO2 + 2H2O
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
Силан при нагревании разлагается:
SiH4 → Si + 2H2
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si+4C-4. Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
SiC +2O2 → SiO2 + CO2
Карборунд окисляется кислородом в расплаве щелочи:
SiC + 2O2 + 4NaOH → Na2SiO3 + Na2CO3 + 2H2O
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем:
SiO2 + C + Cl2 → SiCl4 + CO
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
SiCl4 + 3H2O → H2SiO3↓ + 4HCl
Хлорид кремния (IV) восстанавливается водородом:
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид. За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами. При этом образуются силикаты.
Например, диоксид кремния взаимодействует с гидроксидом калия:
SiO2 + 2KOH → K2SiO3 + H2O
Еще пример: диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой, т. к. кремниевая кислота нерастворима.
к. кремниевая кислота нерастворима.
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов. При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например, оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
SiO2 + K2CO3 → K2SiO3 + CO2
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 4HF(г) = SiF4 + 2H2O
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например, оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
SiO2 + 2Н2 → Si + 2Н2O
Еще пример: оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, при действии соляной кислоты на силикат натрия:
Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Na2SiO3 + 2Н2O + 2CO2 → 2NaHCO3 + H2SiO3
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Например, кремниевая кислота реагирует с концентрированным гидроксидом калия:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
2. При нагревании кремниевая кислота разлагается на оксид и воду:
H2SiO3 → SiO2 + H2O
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1. Растворение кремния, кремниевой кислоты или оксида в щелочи:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + 2H2
SiO2 + 2KOH → K2SiO3 + H2O
2. Сплавление с основными оксидами:
Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2 → CaSiO3 + 2KCl
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато-лиловый.
Понравилось это:
Нравится Загрузка…
Элементы IVА группы. Кремний — Умскул Учебник
На этой странице вы узнаете:
- Физические и химические свойства кремния;
- Песок тоже с кремнием: разберем соединения кремния — силаны, оксиды, силикаты;
- Единственная и неповторимая — поговорим о свойствах кремниевой кислоты.
В чайном сервизе твоей бабушки обязательно найдется кремний, так как диоксид кремния входит в состав стекла. Ну а загорать на пляже без песочка (SiO2) ну просто невозможно (песок встречается на каждом шагу).
Кремний
Кремний встречается во многих веществах и предметах, которые нас окружают. Достаточно вспомнить только солнечные батареи, которые служат альтернативным источником энергии!
Так что же из себя представляет кремний? Он, как и углерод, находится в IVA-группе и имеет конфигурацию внешнего электронного слоя 3s23p2.
В возбужденном состоянии электроны на s-орбитали распариваются, и один из них переселяется на p-орбиталь. В результате, атом приобретает конфигурацию ns1np3.
В результате, атом приобретает конфигурацию ns1np3.
В возбужденном состоянии число неспаренных атомов кремния возрастает до четырех, и кремний приобретает валентность IV:
У кремния возможны следующие степени окисления: -4, +2, +4.
Физические свойства
| Кремний — второй по распространенности элемент на Земле (после кислорода). Кремний встречается только в виде сложных веществ, таких как горный хрусталь, кварц, кремнезем. |
Кристаллическая решётка простого вещества кремния — атомная, сам кремний представляет собой вещество темно-серого цвета с металлическим блеском. Является полупроводником.
Химические свойства кремния
У кремния относительно низкая электроотрицательность. А что это значит? Это значит, что он будет яро проявлять восстановительные свойства, даже ещё более выраженные чем у углерода! Поэтому из неметаллов будет вступать в реакции с типичными окислителями, повышая свою степень окисления до +4:
- Реакции с неметаллами
| Кремний не реагирует с водородом и фосфором в силу близких значений электроотрицательностей! |
- Реакция со щелочами
В отличие от других неметаллов, реагирующих со щелочами, кремний является в этих реакциях только восстановителем, повышая степень окисления до +4:
- А с окислителями реакция идет?
Конечно! Но не со всеми. Отобрать электроны «слабенький» кремний способен только у самых слабых — у металлов. Как и углерод, кремний реагирует в основном с металлами активными и средней активности, образуя силициды:
Отобрать электроны «слабенький» кремний способен только у самых слабых — у металлов. Как и углерод, кремний реагирует в основном с металлами активными и средней активности, образуя силициды:
Как и многие другие бинарные соединения, силициды металлов могут гидролизоваться:
Образующийся бесцветный газ с неприятным запахом — силан — за счёт степени окисления кремния -4 проявляет восстановительные свойства и способен реагировать с окислителями (например, с кислородом):
(оксид кремния(IV) входит в состав песка, который мы видим на улице)
Получение кремния
Кремний в основном получают восстановлением из диоксида кремния SiO2 сильными восстановителями: углеродом, металлами:
Оксид кремния (IV) — кремнезём SiO2
Диоксид кремния — кислотный оксид, главный компонент почти всех земных горных пород. Из кремнезема и силикатов состоит почти 90 % массы литосферы.
- Реакция с водой
Почему же диоксид кремния такой исключительный? Да все потому, что это — единственный кислотный оксид, который не реагирует с водой! Как следствие, ему соответствует нерастворимая кремниевая кислота H2SiO3.
- Основно-кислотное взаимодействие
Как кислотный оксид, SiO2 проявляет кислотные свойства, а значит, способен взаимодействовать с веществами, проявляющими основные свойства, с образованием солей — силикатов:
- А в реакции вытеснения вступает?
Да! SiO2 в реакциях вытеснения — условно «сильный» оксид, способный вытеснять условно «слабые» (CO2, SO2) из их солей при сплавлении (t):
- Реакции с окислителями
За счёт высокой степени окисления кремния +4 SiO2 проявляет слабо выраженные окислительные свойства и может вступать в ОВР, как правило, только с очень сильными восстановителями (например, углеродом или металлами):
Единственная и неповторимая — кремниевая кислота и силикаты
Кремниевая кислота, хоть и нерастворима, но всё-таки проявляет кислотные свойства, взаимодействуя с сильными основаниями (щелочами):
| А ещё силикаты различных металлов образуют красивые нитевидные кристаллы, которые используются в эксперименте « силикатный сад»! |
Её соли — силикаты, как и другие соли, являются электролитами, а значит, способны вступать в РИО с другими электролитами: солями, основаниями, кислотами:
Как нерастворимый гидроксид, кремниевая кислота способна разлагаться при нагревании на воду и соответствующий оксид:
Фактчек
- Кремний — химический элемент IVA группы, третьего периода периодической системы химических элементов Д.
 И. Менделеева, с атомным номером 14.
И. Менделеева, с атомным номером 14. - Возможные степени окисления кремния: -4, +2, +4.
- Электронная конфигурация атома кремния: 1s22s22p63s13p3.
- Кремний за счёт низкой электроотрицательности ярко проявляет восстановительные свойства.
- Кремний образует множество соединений, в том числе оксид кремния SiO2 — кислотный оксид, который соответствует кремниевой кислоте H2SiO3. Соли кремниевой кислоты называются силикатами.
Проверь себя
Задание 1.
Сколько неспаренных электронов содержит атом кремния в возбужденном электронном состоянии?
- 1 электрон;
- 2 электрона;
- 3 электрона;
- 4 электрона.

Задание 2.
С каким из следующих простых веществ не реагирует кремний?
- Углерод;
- Бром;
- Фосфор;
- Кислород.
Задание 3.
С каким из перечисленных веществ будет реагировать диоксид кремния?
- Карбонат натрия;
- Сульфат калия;
- Хлорид рубидия;
- Ортофосфат кальция.
Задание 4.
Какое свойство отличает кремниевую кислоту от других кислот?
- Она содержит атомы кислорода;
- При комнатной температуре кремниевая кислота — жидкость;
- Она нерастворима в воде;
- Она проявляет амфотерные свойства.
Задание 5.
Как называются бинарные соединения кремния и металлов?
- Силаны;
- Силициды;
- Силикаты;
- Силоксаны.
Ответы: 1. — 4; 2. — 3; 3. — 1; 4. — 3; 5. — 2.
— 2.
Какая реакция произойдет, если смешать песок и воду?
Выберите область веб-сайта для поиска
Искать на этом сайте
Цитата страницы
Начать эссе
значок-вопрос
Задайте вопрос
Начать бесплатную пробную версию
Скачать PDF
Цитата страницы
Цитировать
Поделиться ссылкой
Делиться
Ссылайтесь на эту страницу следующим образом:
«Какая реакция происходит, когда вы смешиваете песок и воду?» eNotes Editorial , 18 марта 2016 г., https://www.enotes.com/homework-help/what-reaction-happens-when-you-mix-sand-water-651788.
По состоянию на 4 мая 2023 г.
Ответы экспертов
Когда мы смешиваем песок и воду, никакой реакции не происходит. Песок просто оседает на дно емкости с водой. Это потому, что песок тяжелее воды и, следовательно, не может плавать в воде. Песок можно отделить от воды простой фильтрацией и после высушивания получить в исходном состоянии. Поскольку никакой химической реакции не происходит, мы можем назвать эту реакцию физической реакцией (поскольку за эту реакцию ответственны гравитация и плотность). Отделение песка от воды называется гравитационным разделением.
Песок просто оседает на дно емкости с водой. Это потому, что песок тяжелее воды и, следовательно, не может плавать в воде. Песок можно отделить от воды простой фильтрацией и после высушивания получить в исходном состоянии. Поскольку никакой химической реакции не происходит, мы можем назвать эту реакцию физической реакцией (поскольку за эту реакцию ответственны гравитация и плотность). Отделение песка от воды называется гравитационным разделением.
Для сравнения, если мы смешаем что-то вроде соли или сахара в воде, они вступят в реакцию и сделают воду соленой или сладкой. Песок не вызывает таких изменений качества воды.
Надеюсь, это поможет.
См. eNotes без рекламы
Начните 48-часовую бесплатную пробную версию , чтобы получить доступ к более чем 30 000 дополнительных руководств и более чем 350 000 вопросов помощи при выполнении домашних заданий, на которые наши эксперты ответили.
Получите 48 часов бесплатного доступа
Уже зарегистрированы?
Войдите здесь.
Утверждено редакцией eNotes
Задайте вопрос
Похожие вопросы
Просмотреть все
Наука
Последний ответ опубликован 09 февраля 2016 г. в 1:09:35.
Если аминокислотная последовательность двух организмов одинакова, будет ли похожа и их ДНК? почему ?
1 Ответ преподавателя
Наука
Последний ответ опубликован 17 июля 2012 г. в 14:55:17.
Каковы три части клеточной теории?
16 Ответы педагога
Наука
Последний ответ опубликован 07 декабря 2018 г. в 12:04:01.
Расположите следующие элементы в порядке от большего к меньшему: клетка, хромосома, ген, ДНК, организм, ядро.
3 Ответы воспитателя
Наука
Последний ответ опубликован 19 сентября 2015 г. в 21:37:47.
Каковы четыре основные функции компьютерной системы?
2 Ответы воспитателя
Наука
Последний ответ опубликован 06 июля 2009 г. в 21:23:22.
Каковы функции компьютера?
7 Ответы воспитателя
Получение кремния и силанов из песка | Эксперимент
Нагрейте магний и песок вместе для получения кремния и помогите учащимся изучить, как экзотермические реакции могут создавать новые вещества
Установите защитный экран для этого взрывного практического занятия, наполненного взрывающимся водородом, расплавленным кремнием и кислотой
Этот эксперимент должно пройти от пяти до десяти минут.
Оборудование
Аппаратура
- Защита глаз
- Защитный экран
- Пробирка из пирекса, примерно 150 мм x 17 мм
- Зажим и подставка
- Горелка Бунзена
- Стакан, 250 см 3
- Коническая колба, 250 см 3
- Фильтровальная воронка и фильтровальная бумага
- Доступ к печи
- Эксикатор
- Доступ к верхним чашам весов
Химикаты
- Сухой порошок магния, 1 г
- Сухой серебряный песок, 1 г
- Кислота соляная, 2 моль дм –3 , 50 см 3
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.

- Всегда надевайте защитные очки.
- Используйте защитный экран между аппаратом и аудиторией.
- Порошок магния сильно горит на воздухе. Пыль от порошка магния может быть опасной.
- Перед реакцией убедитесь, что смешанные порошки абсолютно сухие.
- В обязанности учителя входит проверка оценки риска работодателем.
- Порошок магния легко воспламеняется (см. карточку опасности CLEAPSS HC059b).
- Соляная кислота в используемой концентрации вызывает раздражение (см. карту опасности CLEAPSS HC047a).
Процедура
Перед демонстрацией
- Высушите порошок магния и песок в течение нескольких часов в печи при температуре около 100°C.
- Храните их в эксикаторе до момента использования.
- Убедитесь, что пробирка сухая.
Демонстрация
- Взвесьте 1 г серебряного песка и 1 г порошка магния и тщательно перемешайте.
- Распределите смесь по дну пробирки, зажатой почти горизонтально.

- Поместите защитный экран между трубой и зрителями, если зрители находятся близко.
- Нагрейте один конец смеси с ревущим пламенем Бунзена, держа горелку рукой. Через несколько секунд смесь начнет светиться. Это свечение можно «гонять» по трубке с пламенем, пока не прореагирует вся смесь. Трубка почернеет и частично расплавится.
- Если два порошка не высохнут, некоторое количество магния прореагирует с паром, и образовавшийся водород взорвется.
- Когда реакция завершится, дать смеси остыть (около пяти минут) и с помощью шпателя вылить продукты примерно в 50 см 3 2 моль дм –3 соляной кислоты.
- Через несколько минут хлопки прекратятся, и на дне стакана останется серый порошок кремния, возможно, с небольшим количеством непрореагировавшего песка.
- Кислоту слить, твердое вещество несколько раз промыть водой и отфильтровать кремний.
- Обведите класс, чтобы показать его слегка металлический серебристо-серый цвет.
 При желании покажите, что он не реагирует со щелочами (или кислотами).
При желании покажите, что он не реагирует со щелочами (или кислотами).
Примечания
- Диоксид кремния представляет собой твердое вещество с гигантской структурой, тогда как диоксид углерода имеет молекулярную структуру.
- Силаны самопроизвольно реагируют с воздухом при комнатной температуре, тогда как алканы стабильны.
- Эти различия можно объяснить, рассматривая соответствующие энергии связи и наличие d-орбиталей в кремнии, но не в углероде.
- Энергии связи в кДж моль –1 : Si=O 638; Si–O 466; С–О 336; С=О 805; Si-H 318; С– Н 413.
- Реакции:
- SiO 2 (т) + 2Mg(т) → 2MgO(т) + Si(т)
- 2Mg(s) + Si(s) → Mg 2 Si(s)
- MgO(т) + 2HCl(водн.) → MgCl 2 (водн.) + H 2 О(л)
- Mg 2 Si(т) + 4HCl(водн.) → 2MgCl 2 (водн.) + SiH 4 (г)
- Можно также производить высшие силаны, такие как Si 2 H 6
- SiH 4 (г) + 2O 2 (г) → SiO 2 (т) + 2H 2 O(л)
Дополнительная информация
- Эта исходная смесь имеет небольшой избыток магния по отношению к стехиометрической массе (1 г песка на 0,8 г магния), поскольку некоторое количество магния неизбежно будет реагировать с воздухом.


 И. Менделеева, с атомным номером 14.
И. Менделеева, с атомным номером 14.


 При желании покажите, что он не реагирует со щелочами (или кислотами).
При желании покажите, что он не реагирует со щелочами (или кислотами).