Содержание
Порошковые реагенты Powder Pillows на нитрат, 0,3
Артикул: 2106169
Производитель: Hach
Наличие: В наличии
Заказать
Добавить в сравнение
Порошковые реагенты Powder Pillows для определения нитратов. Диапазон измерений 0,3 — 30 мг/л NO3-N (высокий диапазон) / 0,1 — 10,0 мг/л NO3-N (средний диапазон). Количество тестов в упаковке — 100 штук.
Набор реагентов Powder Pillows на алюминий, 0,008 — 0,800 мг/л Al
Артикул: 2242000
Набор реагентов на алюминий, 0,002 — 0,250 мг/л Al
Артикул: 2603700
Порошковые реагенты Powder Pillows на аммонийный азот, 0,01 — 0,50 мг/л Nh4-N
Артикул: 2653299
Описание
Характеристики
Документация
Рекомендуемые товары
Описание
Описание
Пакетированные порошковые реагенты Powder Pillows NitraVer 5 (2106169) для определения нитрата от производителя Hach. Используется для анализа воды, морской воды, мониторинга сточных вод.
Используется для анализа воды, морской воды, мониторинга сточных вод.
Пакетированные реагенты Powder Pillows герметично запечатаны в пакетики из фольги, что обеспечивает им многолетний срок хранения. Реагент просто заливают в измерительную кювету вместе с образцом. Анализ производится визуально, например, при помощи цветового диска или на фотометре HACH LANGE.
Параметр: Нитрат.
Описание метода: Металлический кадмий восстанавливает нитрат в образце до нитрита. Ион нитрита реагирует в кислой среде с сульфаниловой кислотой с образованием промежуточной соли диазония. Соль соединяется с гентизиновой кислотой с образованием раствора янтарного цвета. Длина волны измерения составляет 400 нм для спектрофотометров или 420 нм для колориметров.
Характеристики
Характеристики
| Область применения | Экологический мониторинг, Тест-наборы, Сточные воды, Реагенты, Производство продуктов питания, Питьевая вода, Контроль технологических процессов |
| Тип | Пакетированные реагенты |
| Индустрия | Экология, Целлюлозно-бумажная, Фармацевтическая, Стекольная, Энергетика, Транспорт, Химическая, Еда и напитки, Муниципальная |
| Параметры | Нитрат |
| Диапазон Измерений | 0,3 — 30 мг/л NO3-N |
| Совместимость | DR6000, DR1900, DR900, DR3900, DR5000, DR2800, DR3800, DR300 (Нитрат) |
| Метод | Восстановление кадмия |
| Количество тестов | 100 |
| Диапазон Измерений (2) | 0,1 — 10,0 мг/л NO3-N |
| Контроль качества | 30749 |
Документация
Документация
| Методика Powder Pillows 2106169: Нитрат (HR) | |||
| Методика Powder Pillows 2106169: Нитрат (MR) |
Рекомендуемые товары
Рекомендуемые товары
Набор реагентов Powder Pillows на кремний, 0,010 — 1,600 мг/л SiO2
Порошковые реагенты Powder Pillows для определения кремния, диапазон измерений 0,010 — 1,600 мг/л SiO2.
Артикул: 2459300
Посмотреть товар
Сравнить
Порошковый реагент на цинк ZincoVer 5 Powder Pillows
Реактив для определения цинка в пробе воды в диапазоне 0.01 — 3.00 Zn на спектрофотометре или колориметре.
Артикул: 2106669
Посмотреть товар
Сравнить
Порошковый реагент Powder Pillows Sulfite 1
Реактив для определения общего хлора, перекиси водорода и сульфита. Упаковка для выполнения 100 тестов.
Артикул: 220399
Посмотреть товар
Сравнить
Порошковый индикатор для определения хлорида Chloride 2, Powder Pillows, 50 шт.
Индикатор Chloride 2, Powder Pillows для определения хлорида (аргентометрическое титрование), 50 шт.
Артикул: 105766
Посмотреть товар
Сравнить
Набор реагентов Powder Pillows на четвертичные соединения аммония, 0,2 — 5,0 мг/л в виде ЦТАБ
Набор реагентов Powder Pillows для определения четвертичных соединений аммония, диапазон измерений 0,2 — 5,0 мг/л в виде ЦТАБ (цетилтриметиламмоний бромид).
Артикул: 2459200
Посмотреть товар
Сравнить
Порошковый индикатор для определения жесткости ManVer 2, Powder Pillows, 100 шт.
Индикатор ManVer 2, Powder Pillows для определения общей жесткости титрованием, 100 шт.
Артикул: 85199
Посмотреть товар
Сравнить
Порошковые реагенты Powder Pillows на медь CuVer 1, 0,04 — 5,00 мг/л Cu
Порошковые реагенты Powder Pillows для определения меди, диапазон измерений 0,04 — 5,00 мг/л Cu.
Артикул: 2105869
Посмотреть товар
Сравнить
Порошковые реагенты Powder Pillows UniVer 3, жесткость
Порошковые реагенты Powder Pillows UniVer 3 для совместного использования с цифровым титратором Hach.
Артикул: 96299
Посмотреть товар
Сравнить
Набор реагентов на алюминий, 0,002 — 0,250 мг/л Al
Набор реагентов для определения Алюминия, диапазон измерений 0,002 — 0,250 мг/л Al.
Артикул: 2603700
Посмотреть товар
Сравнить
Порошковые реагенты Powder Pillows на хром, 0,010 — 0,700 мг/л Cr (VI)
Порошковые реагенты Powder Pillows для определения хрома, диапазон измерений 0,010 — 0,700 мг/л Cr (VI).
Артикул: 1271099
Посмотреть товар
Сравнить
Буфер Powder Pillows, pH 10.01 синий 250 шт.
Стандарт для калибровки электродов. pH буфер в порошке для разведения. Цветовая кодировка — синий.
Артикул: 2227164
Посмотреть товар
Сравнить
SulfaVer 4 реагент для определения сульфата 2 — 70 мг/л SO4
Порошковый реактив Hach для определения сульфатов в пробе воды, сточной воде и морской воде.
Артикул: 1206599
Посмотреть товар
Сравнить
Гранулы гидроксида калия, 25 г
КОН (поглотитель СО2). Используется при определении БПК5 на анализаторе BODTrak II.
Артикул: 31425
Посмотреть товар
Сравнить
Набор реагентов Powder Pillows на нитрат, 0,01 — 0,50 мг/л NO3-N
Порошковые реагенты Powder Pillows для определения нитратов, диапазон измерений 0,01 — 0,50 мг/л NO3-N.
Артикул: 2429800
Посмотреть товар
Сравнить
Пакетики с порошковым реагентом 3 для определения калия, 100 шт./уп.
Порошковый реагент в герметичных упаковках для анализа калия, 0,1 — 7,0 мг/л K. Количество в упаковке — 100 штук.
Артикул: 1432399
Посмотреть товар
Сравнить
Набор реагентов Powder Pillows на никель, 0,02 — 1,80 мг/л Ni
Порошковые реагенты Powder Pillows для определения никеля, диапазон измерений 0,02 — 1,80 мг/л Ni.
Артикул: 2243500
Посмотреть товар
Сравнить
Порошковые реагенты Powder Pillows на ортофосфат, 0,02 — 2,50 мг/л PO4
Порошковые реагенты Powder Pillows для определения фосфата (орто), диапазон измерений 0,02 — 2,50 мг/л PO4.
Артикул: 2106028
Посмотреть товар
Сравнить
Порошковые реагенты Powder Pillows на нитрит, 0,002 — 0,300 мг/л NO2-N
Порошковые реагенты NitriVer 3 Powder Pillows для определения нитритов, диапазон измерений 0,002 — 0,300 мг/л NO2-N.
Артикул: 2107169
Посмотреть товар
Сравнить
Порошковые реагенты Powder Pillows на ортофосфат, 0,02 — 2,50 мг/л PO4
Порошковые реагенты Powder Pillows для определения фосфата (орто), диапазон измерений 0,02 — 2,50 мг/л PO4.
Артикул: 2106069
Посмотреть товар
Сравнить
Набор реагентов для определения фенолов, 0,002 — 0,200 мг/л
Комплект реактивов для определения фенолов в воде, диапазон измерений 0,002 — 0,200 мг/л.
Артикул: 2243900
Посмотреть товар
Сравнить
Порошковый реагент, дифенилкарбазон, Powder Pillows, 100 шт.
Порошковый реагент в герметичных упаковках для определения хлорида титрованием.
Артикул: 83699
Посмотреть товар
Сравнить
Набор реагентов Powder Pillows на молибден, 0,3 — 40,0 мг/л Mo
Порошковые реагенты Powder Pillows для определения молибдена (HR), диапазон измерений 0,3 — 40,0 мг/л Mo.
Артикул: 2604100
Посмотреть товар
Сравнить
Порошковый реагент для определения кремния, Powder Pillows, 100 шт.
Порошковый реагент, Powder Pillows, в герметичных упаковках для определения содержания кремния (высокий диапазон), метод силикомолибдата. Также используется для определения гипхлорита высокого диапазона (йодометрический метод).
Артикул: 104299
Посмотреть товар
Сравнить
Порошковый реагент для определения аммиачного азота 0,01 — 0,50 мг/л Nh4-N
Порошковый реагент Powder Pillows цианурат аммиака, 10 мл, упаковка 100 шт.
Артикул: 2653199
Посмотреть товар
Сравнить
Рекомендуемые товары
Пакетики Powder Pillows с обесцвечивающим (3) порошковым реагентом, 100 шт./уп.
Порошковый реагент в герметичной упаковке для определения алюминия, 0,008 — 0,800 мг/л Al, алюминоновый метод. Количество тестов в упаковке — 100 штук.
Артикул: 1429449
Посмотреть товар
Сравнить
Набор реагентов Powder Pillows на нитрат, 0,01 — 0,50 мг/л NO3-N
Порошковые реагенты Powder Pillows для определения нитратов, диапазон измерений 0,01 — 0,50 мг/л NO3-N.
Артикул: 2429800
Посмотреть товар
Сравнить
Набор реагентов Powder Pillows на фосфонаты, 0,02 — 125 мг/л PO4
Порошковые реагенты для определения фосфонатов в воде.
Артикул: 2429700
Посмотреть товар
Сравнить
Комплект реагентов на диоксид хлора, 0,04 — 5,00 мг/л ClO2
Порошковые реагенты Powder Pillows для определения диоксида хлора, диапазон измерений 0,04 — 5,00 мг/л ClO2.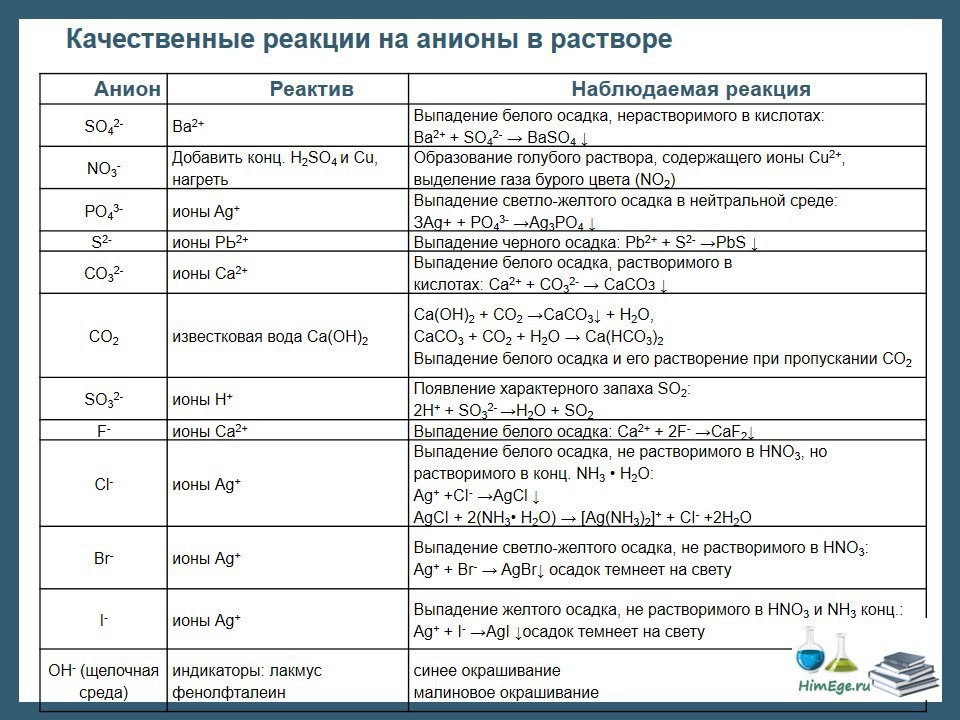
Артикул: 2770900
Посмотреть товар
Сравнить
Набор реагентов Powder Pillows на цианид, 0,002 — 0,240 мг/л CN
Порошковые реагенты Powder Pillows для определения цианида, диапазон измерений 0,002 — 0,240 мг/л CN.
Артикул: 2430200
Посмотреть товар
Сравнить
Порошковые реагенты Powder Pillows на ортофосфат, 0,02 — 2,50 мг/л PO4
Порошковые реагенты Powder Pillows для определения фосфата (орто), диапазон измерений 0,02 — 2,50 мг/л PO4.
Артикул: 212528
Посмотреть товар
Сравнить
Набор реагентов Powder Pillows на алюминий, 0,008 — 0,800 мг/л Al
Пакетированные реагенты Powder Pillows для определения Алюминия, диапазон измерений 0,008 — 0,800 мг/л Al.
Артикул: 2242000
Посмотреть товар
Сравнить
Набор реагентов Powder Pillows на кремний, 0,010 — 1,600 мг/л SiO2
Порошковые реагенты Powder Pillows для определения кремния, диапазон измерений 0,010 — 1,600 мг/л SiO2.
Артикул: 2459300
Посмотреть товар
Сравнить
Набор реагентов Powder Pillows на серебро, 0,02 — 0,70 мг/л Ag
Порошковые реагенты Powder Pillows для определения cеребра, диапазон измерений 0,02 — 0,70 мг/л Ag.
Артикул: 2296600
Посмотреть товар
Сравнить
Групповым реагентом анионов II группы
Раствор
нитрата серебра в присутствии азотной
кислоты является:групповым
реагентом анионов III группыгрупповым
реагентом анионов II и III группне
является групповым реагентом
Окислителями
являются: а) нитрит-ионы; б) бромид-ионы;
в) ацетат-ионы; г) нитрат-ионы.
1) все 2)
а, в 3)
а, г 4)
б, в
Установите
соответствие между анионом и реагентом
для его обнаружения.
Анион
Реагент
хлоридБ
А) BaCl2
2)
нитратВ
Б) AgCl
3)
ацетатГ
В) Al, NaOH
Г) FeCl3
Приведите
уравнение реакции взаимодействия
сульфид-иона с солью кадмия. Укажи-те
аналитический эффект, условия протекания
реакции.
Напишите
уравнение диссоциации комплексного
иона и рассчитайте равновесную
концентрацию ионов цинка в 0,01М растворе
[Zn(NH3)4]2+.
Групповым
реагентом на анионы NO
3
, NO
2
, СН3СОО–
является:
1)
раствор AgNO3
в присутствии
HNO33)
раствор BaCl2
2)
раствор AgNO3
4)
группового
реагента нет
Укажите соли,
которые образуют осадки желтого цвета
с раствором нитрата серебра в разбавленной
азотной кислоте: а) иодид натрия; б)
сульфид натрия; в) бромид натрия;
г) хлорид аммония.
1) а,
в 2)
а, в, г 3)
все 4)
б, в
Установите
соответствие между анионом и реагентом
для его обнаружения.
Анион
Реагент
1) I–
3А) этанол в
присутствии серной кислоты2)
S2–
4Б) антипирин
3)
СН3СОО–
2В) серная кислота
4) NO2
—
1Г) хлорная вода,
хлороформ
Органические
производные азотной кислоты
нитроглицерин,нитросорбит,нитранол,
широко применяются в медицинской
практике как сердечные средства при
коронарной недостаточности
Приведите
уравнение реакции взаимодействия
нитрат-иона с алюминием. Укажите
Укажите
аналитический эффект, условия протекания
реакции.
Напишите
уравнение диссоциации комплексного
иона и рассчитайте равновесные
концентрации ионов никеля и аммиака в
0,20 моль/л растворе [Ni(NH3)6]2+.
Окислительно-восстановительной
двойственностью обладает:
1) нитрат-ион 2)
нитрит-ион 3)
сульфд-ион 4)
ацетат-ион
Нитратом
серебра в присутствии азотной кислоты
осаждаются: а) Cl–;
б) S2–;
в) Br–;
г)
CН3CОО–.
1)
все 2)
а, г 3)
а, в 4)
а,б,в
Установите
соответствие между групповым реагентом
и группой анионов.
Реагент
Анионы
1)
AgNO3+HNO3АА) I—,
S2—,
Br—2)
BaCl2Б) NO3—,
CH3COO—,
NO2—
Отсутствие
общего реагентаБ
При
стенокардии в медицинской практике
применяют нитрит натрия и производные
Приведите
уравнение реакции взаимодействия
нитрит-иона с соляной кислотой. Ука-жите
Ука-жите
аналитический эффект, условия протекания
реакции.
Напишите
уравнение диссоциации комплексного
иона и рассчитайте равновесные
концентрации ионов цинка и гидроксид-ионов
1 моль/л растворе тетрагидроксоцинка-та
натрия.
Индифферентным
является:
1) иодид-ион 2)
нитрит-ион 3)
сульфд-ион 4)
ацетат-ион
Раствор
перманганата калия в кислой среде
обесцветится в присутствии анионов:
а) I–;
б)
NO2
; в)
NO
3
; г) CrO
24
1)
а, б2) в, г
3)
всех анионов4) б,в
Установите
соответствие между анионом и его
фармакопейным реагентом.
Анион
Фармакопейный
реагент1)
Br——
2А) H2SO4
2)
NO23Б) FeCl3
3)
Ch4COO- В)
BaCl2
1Г)
AgNO3
Как
противоядие при отравлении синильной
кислотой в медицинской практике ис-
пользуется ряд
производных АЗОТИСТОЙ КИСЛОТЫ
Приведите
уравнение реакции взаимодействия
ацетат-иона с хлоридом железа(III). Укажите
аналитический эффект, условия протекания
реакции.
Напишите
уравнение диссоциации комплексного
иона и рассчитать равновесную
кон-центрацию иона хрома(III) в 0,1 моль/л
растворе тетрагидроксохромата(III).
Тема: «Качественный
анализ анионов»
Укажите соли,
которые образуют окрашенные осадки с
раствором нитрата серебра в разбавленной
азотной кислоте:
1)
сульфид калия 2)
фосфат натрия 3)
сульфат аммония 4) хлорид калия
Укажите
соли, которые образуют осадки с хлоридом
бария, нерастворимые в разбав-
ленной соляной
кислоте: а) карбонат натрия; б) оксалат
натрия; в) гидрофосфат на-
трия; г) сульфат
натрия.1)
все2) в, г
3) б, в, г
4)
г
Из
перечисленных веществ подберите
реагенты для обнаружения следующих
анио-
нов:
Анион
Реагент
1) NO3—
2А) нитрат серебра
2) PO43-
1Б) антипирин
3) CO3
2-
3В) разбавленная
серная кислота4) CH3COO—
4Г) этанол
Групповым
реагентом на анионы карбонат, фосфат,
оксалат, сульфат является
ХЛОРИД БАРИЯ .
Составьте
уравнение окислительно-восстановительной
реакции ионно-электронным методом,
укажите окислитель и восстановитель,
рассчитайте молярные массы эквива-лентов
окислителя и восстановителя: KMnO4
+ Na2SO3
+ H2SO4→
Рассчитайте
константу равновесия реакции окисления
иодид — ионов ионами железа (III) в
стандартных состояниях веществ.
Специфическим
реагентом на PO
34
–ион
является:
1)
молибденовая жидкость 2)
BaCl2 3)
I2 4)
нитрат серебра
Какие
ионы осаждаются нитратом серебра в
присутствии 2 моль/л азотной кислоты:
а) хлорид – ион; б) сульфид – ион; в)
бромид-ион; г) фосфат-ион
1) все 2)
а, г 3)
а, в 4)
а,б,в
Из
перечисленных веществ подберите
реагенты для обнаружения следующих
анио-
нов:
Анион
—
Реагент
1) NO2
3А) магнезиальная
смесь2)
S2-
3-
Б) хлорная вода
3)
РO4
2В) хлорид кадмия
1Г) серная кислота | 2-, | |||
10. | SO3 | является | ||
Хлорид бария | ||||
Составьте
уравнение окислительно-восстановительной
реакции ионно-электронным методом,
укажите окислитель и восстановитель,
рассчитайте молярные массы эквива-лентов
окислителя и восстановителя: KMnO4
+ NaBr + H2SO4→
22
Рассчитайте,
можно ли окислить бромид — ионы раствором,
содержащим дихромат калия и хлорид
хрома(III) с молярными концентрациями
0,10 моль/л при рН 2.
Специфическим
реагентом на нитрит-ион является:
1) дифениламин 2)
реактив Грисса 3)
иодид калия 4)
нитрат серебра
При
подкислении каких солей выделяется
газ: а) хлорид аммония ; б) сульфит натрия;
в) оксалат натрия; г) карбонат натрия
1) б, г 2)
б, в, г 3)
а,в 4)
а, б, г
Из
перечисленных веществ подберите
реагенты для обнаружения следующих
анио-
нов:
Анион
I—
S2O32-
B4O72-
Реагент
3А) этанол
Б) антипирин
2В) серная кислота
1Г)
хлорная вода, хлороформ
Фармакопейным
реагентом на фосфат — ион является
нитрат серебра магнезиальная смесь_
.
Составьте уравнение
окислительно-восстановительной реакции
ионно-электронным методом, укажите
окислитель и восстановитель, рассчитайте
молярные массы эквива-лентов окислителя
и восстановителя: KMnO4
+ NaNO2
+ H2SO4→
Рассчитайте
константу равновесия реакции: Br—+
MnO4—+
H+Br2+
Mn2+
+ H2О.
Укажите
анионы, которые не
обесцвечивают
раствор перманганата калия в сернокис-лой
среде:
1) сульфит-ион 2)
сульфат-ион 3)
нитрит-ион 4)
ацетат-ион
Свойства
восстановителей проявляют анионы: а)
I–
б) NO
2;в)
MnO
4
; г) CrO
24
1)
а, б 2)
в, г 3)
все анионы 4)
а,в
Групповыми
реагентами для групп анионов служат:
Реагент
Анионы
1)
BaCl2
и CaCl2 Б,ВА) I—,
SCN—,
Br—2) AgNO3+HNO3А
Б) SO3
2-,
CO32-,
NO2—
3) H2SO4
2МВ) PO4
3-,
C2O42-,SO42-
4)
Отсутствие
общего реагентаГГ) NO3
—,
CH3COO—,
NO2—
Фармакопейным
реагентом на тиосульфат — ион является
нитрат серебра,минеральные кислоты
Составьте уравнение
окислительно-восстановительной реакции
ионно-электронным методом, укажите
окислитель и восстановитель, рассчитайте
молярные массы эквива-лентов окислителя
и восстановителя: I2
+ Na2SO3
+ H2SO4→
Рассчитайте,
можно ли в стандартных состояниях
веществ осуществить реакцию окисления
бромид — ионов до свободного брома
перманганат — ионами в кислой среде.
Выберите
реагент для фармакопейного определения
иодид-ионов:
1) нитрат свинца 2)
серная кислота 3)
хлорная вода 4)
нитрит натрия
Свойства
окислителей проявляют анионы: а) NO3—
; б) S2-;
в) I–;
г) MnO4—
1) а, б 2)
а, г 3)
а, б, г 4)
в, г
Из
перечисленных веществ подберите
реагенты для обнаружения следующих
анио-
нов:
Анион
Br—
SO32-
NO3—
Реагент
2А) хлороводородная
кислота
Б) сульфид аммония
1В) хлорная вода,
хлороформ
3Г)
алюминий, гидроксид натрия
Фармакопейным
реагентом на оксалат — ион является
нитрат серебра .
23
Составьте
уравнение окислительно-восстановительной
реакции ионно-электронным методом,
укажите окислитель и восстановитель,
рассчитайте молярные массы эквива-лентов
окислителя и восстановителя: KMnO4
+ Na2SO3
+ H2O→
Рассчитайте
реальный окислительно-восстановительный
потенциал системы, полу-ченной при
смешивании 0,15 моль/л раствора сульфата
церия (IV) и 0,050 моль/л рас-твора сульфата
церия (III).
Укажите
соли, которые образуют осадки желтого
цвета с раствором нитрата серебра в
разбавленной азотной кислоте:
1)
иодид натрия 2)
сульфид натрия 3)
бромид натрия 4)
тиоцианат аммония
Раствор
перманганата калия в среде, созданной
серной кислотой, обесцветится в
при-сутствии анионов: а) иодид; б) нитрит;
в) нитрат; г) хромат.
1) а, б 2)
в, г 3)
всех анионов 4)
б, в
Укажите
соответствие между анионом и специфическим
реагентом для его определе-ния:
Анион
Специфический
реагент1)
Фосфат Б
А) нитрит натрия
2)
Тиоцианид Г
Б) молибденовая
жидкость3)
Бромид В
В) хлорная вода
4)
Иодид А
Г) железо(III)
Фармакопейным
реагентом на тетраборат — ион является
проба окрашивания пламени сложными
эфирами борной кислоты .
Составьте
уравнение окислительно-восстановительной
реакции ионно-электронным методом,
укажите окислитель и восстановитель,
рассчитайте молярные массы эквива-лентов
окислителя и восстановителя: K2Cr2O7
+ KI + H2SO4→
Окислительно-восстановительный
потенциал редокс-пары олово(IV)–олово(II)
равен 0,20 В. Чему равно отношение молярных
концентраций окисленной и восстановлен-ной
форм редокс — пары в растворе?
Тема: «Методы
разделения и концентрирования. Экстракция»
Экстракция
– это метод :
1)
адсорбции веществ
2)
разделения
и концентрирования3)
соосаждения и
кристаллизации4)
конденсирования
и испарения
Коэффициент
распределения D – это …
1)
истинная
термодинамическая константа равновесия3) D
= c(орг. )
)
/ c(водн.)2)
условная
концентрационная константа равновесия4) D = c(водн.)
с(орг.)
Выберите
неверное
утверждение:
чем
больше число экстракций, тем больше
степень извлечения экстрагируемого
вещества
чем больше объем
органической фазы экстрагента, тем
больше степень извлечения экстрагируемого
вещества
степень
извлечения вещества не зависит от рН
водной среды
если
степень извлечения > 99,9%, то достаточно
одной экстракции для количест-венного
извлечения вещества
Для
дробного обнаружения иона Cr(III) в
присутствии других катионов используют
метод экстракции:
потому
что получаемая надхромовая кислота
неустойчива в водных растворах, а
устойчива в органических растворителях
ион
Cr (III) в щелочной среде окисляется до
хромат-анионахромовая
кислота окрашивает органический слой
в красный цветхромовая
кислота окрашивает водный раствор в
синий цвет
24
Экстракцию
в фармации применяют для открытия:
1)
катионов калия
и натрия2)
сульфат- и
карбонат- ионов3)
пероксида
водорода и перманганата калия4)
бромид-
и иодид-ионов
Вычислите
равновесную концентрацию ионов ртути(II)
в 0,1 моль/дм3
растворе тет-раиодомеркурата(II),
содержащем 0,2 моль/дм3
иодида калия.
В
жидкостной экстракции используют:
2
несмешивающиеся жидкие фазы — органический
растворитель и водный раствор разделяемых
веществ
2
несмешивающиеся жидкие фазы –
неорганический растворитель и
органический раствор разделяемых
веществ
2
несмешивающиеся жидкие фазы –
органический и неорганический
растворители
2
смешивающиеся жидкие фазы – органический
растворитель и раствор разделяе-мых
веществ
Математическое
выражение закона распределения
Нернста-Шилова следующее:
1)
Р = а(орг.)
а(водн.)3)
Р = а(водн.
 )
)
/ а(орг.)2) Р
= а(орг.)
/ а(водн.)4)
Р = а(орг.)
– а(водн.)
Из
следующих утверждений неверным
является:маскирующие
агенты могут повысить селективность
экстракциистепень
извлечения экстрагируемого вещества
сильно зависит от рН водной фазы
для
экстракционного концентрирования
используют соэкстракцию и подавление
экстракции
Нитратный реагент B — молекулярное депо
Распродажа!
Нитратный реагент B
395,00 $
Номер по каталогу: B2013040 (50 мл)
Nitrate Reagent B представляет собой высококачественный α-нафтиламин и сульфаниловую кислоту, используемые для обнаружения восстановления нитратов бактериями. Этот продукт использовался в качестве молекулярного инструмента для различных биохимических приложений. Он также использовался в широком спектре других химических и иммунологических приложений. Пользовательские оптовые количества этого продукта доступны по запросу.
Этот продукт использовался в качестве молекулярного инструмента для различных биохимических приложений. Он также использовался в широком спектре других химических и иммунологических приложений. Пользовательские оптовые количества этого продукта доступны по запросу.
Запрос об этом продукте в режиме реального времени с помощью текстового/SMS: 1-858-900-3210.
В наличии
Количество нитратного реагента B
Артикул: B2013040
Категории: Буферы и растворы, Химические вещества
Тег: МД 1000
Описание
Как заказать
Описание
Нитратный реагент B
Каталожный номер: B2013040
Номер партии: Зависит от партии
Срок годности: Зависит от партии
Количество: 50 мл
Молекулярная масса или концентрация: Н/Д
Поставляется как: 900 16 Solution
Применение: молекулярный инструмент для различных биохимических применения
Хранение: 2-8°C
Ключевые слова: Раствор сульфаниловой кислоты, 4-Аминобензолсульфокислота
Марка: Биотехнологическая чистота. Все продукты имеют высокую степень очистки. Все растворы приготовлены из сверхчистой воды типа I (удельное сопротивление >18 МОм·см) и отфильтрованы через 0,22 мкм.
Все продукты имеют высокую степень очистки. Все растворы приготовлены из сверхчистой воды типа I (удельное сопротивление >18 МОм·см) и отфильтрованы через 0,22 мкм.
Ссылки:
1: Wang Z, Chen W, Zuo L, Xu M, Wu Y, Huang J, Zhang X, Li Y, Wang J, Chen J, Wang H, Sun H. The Fibrillin-1/ Сигнальная ось VEGFR2/STAT2 способствует химиорезистентности посредством модулирования гликолиза и ангиогенеза в органоидах рака яичников и клетках Cancer Commun (Lond). 2022 март; 42(3):245-265.
2: Yang Y, Li S, Qu Y, Wang X, An W, Li Z, Han Z, Qin L. Нитраты частично ингибируют воспаление, вызванное липополисахаридами, поддерживая функцию митохондрий J Int Med Res. 2020 Февраль;48(2):300060520
5.
3: Jobgen WS, Jobgen SC, Li H, Meininger CJ, Wu G. Анализ нитритов и нитратов в биологических образцах с использованием высокоэффективной жидкостной хроматографии J Chromatogr B Analyt Technol Biomed Life Sci. 2007 г., 15 мая; 851 (1–2): 71–82.
4: Руис-Эррера Дж. , ДеМосс Дж.А. Нитратредуктазный комплекс Escherichia coli K-12: участие специфических компонентов формиатдегидрогеназы и цитохрома b1 в восстановлении нитратов J Bacteriol. 1969 г., сен; 99 (3): 720-9.
, ДеМосс Дж.А. Нитратредуктазный комплекс Escherichia coli K-12: участие специфических компонентов формиатдегидрогеназы и цитохрома b1 в восстановлении нитратов J Bacteriol. 1969 г., сен; 99 (3): 720-9.
5: Ингам Л., Губаш С.М. Определение активности бактериальной нитратредуктазы с использованием порошкообразного реагента и методов экспресс-мазка по сравнению с обычным тестом Zentralbl Bakteriol. 1993 июня; 279(2):225-30.
6: Fu F, Dionysiou DD, Liu H. Использование нульвалентного железа для восстановления грунтовых вод и очистки сточных вод: обзор J Hazard Mater. 2014 28 февраля; 267: 194-205.
7: von der Fecht-Bartenbach J, Bogner M, Dynowski M, Ludewig U. CLC-b-опосредованный обмен NO-3/H+ в тонопласте Arabidopsis vacuoles Plant Cell Physiol. 2010 июнь; 51 (6): 960-8.
8: Сакалаускайте Ю., Вискелис П., Дамбраускене Э., Сакалаускене С., Самуолиене Г., Бразайтите А., Духовскис П., Урбонавичене Д. Влияние различной интенсивности УФ-В излучения на морфологические и биохимические характеристики Ocimum basilicum L J Sci Food Agric. 2013 апр;93(6):1266-71.
2013 апр;93(6):1266-71.
9: Холленберг С.М. Вазодилататоры при острой сердечной недостаточности Heart Fail Rev. 2007 Jun; 12(2):143-7.
10: Джардина Дж. Б., Грин Г. М., Риневальт А. Н., Грейнджер Дж. П., Халил Р. А. Роль рецепторов эндотелина B в усилении эндотелий-зависимой релаксации сосудов, опосредованной оксидом азота, во время диеты с высоким содержанием соли Гипертония. 2001 г., февраль; 37 (2 часть 2): 516-23.
Продукты, относящиеся к нитратному реагенту B, можно найти по адресу Chemicals
Как сделать заказ
1- Закажите онлайн, используя автоматизированную корзину для покупок и систему оформления заказа на нашем веб-сайте (доступно круглосуточно и без выходных).
2- Заказать по электронной почте: [email protected] (мы принимаем электронные заказы, доступны 24/7).
3- Заказ по факсу: 1-858-437-9884 (работает круглосуточно и без выходных).
4- Заказ по телефону: 1-858-900-3210 (с 6:00 до 20:00 по тихоокеанскому времени).
5- Заказ по тексту/SMS: 1-858-900-3210 (с 6:00 до 20:00 по тихоокеанскому стандартному времени).
Тест на восстановление нитратов – принцип, процедура, применение и интерпретация
Последнее обновление: Сагар Арьял0108 2 ). Многие грамотрицательные бактерии используют нитраты в качестве конечного акцептора электронов.
Тест на восстановление нитратов — это тест, определяющий выработку фермента, называемого нитратредуктазой, что приводит к восстановлению нитратов (NO3).
Виды бактерий можно дифференцировать на основе их способности восстанавливать нитраты до нитритов или азотистых газов.
Цели
- Определить способность организма восстанавливать нитраты до нитритов.
- Определите различные пути восстановления нитратов бактериями
Принцип
Плотный инокулят тестируемого организма инкубируют в бульоне, содержащем нитрат. Организмы, способные продуцировать фермент нитратредуктазу, восстанавливают нитрат, присутствующий в бульоне, до нитрита, который затем может быть дополнительно восстановлен до оксида азота, оксида азота или азота.
Организмы, способные продуцировать фермент нитратредуктазу, восстанавливают нитрат, присутствующий в бульоне, до нитрита, который затем может быть дополнительно восстановлен до оксида азота, оксида азота или азота.
Тест на восстановление нитратов основан на обнаружении нитрита и его способности образовывать соединение красного цвета при взаимодействии с сульфаниловой кислотой с образованием комплекса (нитрит-сульфаниловая кислота), который затем реагирует с α-нафтиламином с образованием красный осадок (пронтосил), представляющий собой водорастворимый азокраситель.
Однако только при наличии нитратов в среде появляется красный цвет. Если после добавления сульфаниловой кислоты и α-нафтиламина в среде нет красного цвета, это означает только то, что в среде нет нитритов.
Этому наблюдению есть два объяснения.
- Содержание нитратов может быть не восстановлено; штамм нитрат-отрицательный.
- Нитрат может быть восстановлен до нитрита, который затем полностью восстановлен до оксида азота, закиси азота или азота, который не будет реагировать с реагентами, реагирующими с нитритом; штамм является нитрат-положительным.

Таким образом, если нитриты не обнаружены, необходимо проверить, восстановил ли организм нитраты сверх нитритов. Это можно сделать косвенно, добавив в культуру небольшое количество порошка цинка. Цинковый порошок катализирует восстановление нитратов до нитритов. Появление красного цвета при добавлении цинка указывает на то, что организм не восстанавливал нитраты, что свидетельствует о том, что испытуемый организм не способен восстанавливать нитраты. Если после добавления цинка не происходит изменения цвета, это указывает на то, что организм восстановил нитрат до одного из других соединений азота и, таким образом, является восстановителем нитратов.
Примечание: Пробирку Дарема помещают в азотный бульон, чтобы определить ухудшение состояния бульона перед инокуляцией, о чем свидетельствует образование газа в пробирке, и определить денитрификацию организмами, которые выделяют газ альтернативными путями.
Среда:
Нитратный бульон
Пептон 5 г/л, Мясной экстракт 3 г/л, Нитрат калия 1 г/л.
Конечный pH 7,0 ± 0,2 при 25°C
Метод
Определение восстановления нитратов до нитритов представляет собой двухэтапный процесс. Сначала определяют восстановление нитратов до нитритов добавлением нитратных реагентов А и В, затем, при необходимости, определяют восстановление нитратов до уровня нитритов добавлением нитратного реагента С (цинковая пыль).
- Инокулировать нитратные бульоны бактериальной суспензией.
- Инкубируйте пробирки при оптимальной температуре 30°C или 37°C в течение 24 часов.
- После инкубации прежде чем добавлять реагенты, проверьте наличие газообразного азота.
- Добавьте 6–8 капель нитритного реагента A и добавьте 6–8 капель нитритного реагента B.
- Наблюдайте за реакцией (развитием окраски) в течение минуты или меньше.
- Если цвет не появляется, добавьте порошок цинка.
- В течение не менее 3 минут наблюдайте за появлением красного цвета после добавления цинка.
Ожидаемые результаты
- Положительный тест:
– Развитие вишнево-красного окрашивания при добавлении реагентов А и В
– Отсутствие развития красного окрашивания при добавлении порошка Zn - Отрицательный тест: 900 16
-А появление красного цвета при добавлении порошка Zn
Применение
- Все представители семейства Enterobacteriaceae восстанавливают нитраты, но некоторые представители далее метаболизируют нитрит в другие соединения.
 Таким образом, он используется для дифференциации представителей Enterobacteriaceae, которые продуцируют фермент нитратредуктазу, от грамотрицательных бактерий, которые не продуцируют фермент нитратредуктазу.
Таким образом, он используется для дифференциации представителей Enterobacteriaceae, которые продуцируют фермент нитратредуктазу, от грамотрицательных бактерий, которые не продуцируют фермент нитратредуктазу. - Восстановление нитратов может быть связано с анаэробным дыханием у некоторых видов.
- Используется для дифференциации Mycobacterium
- Идентификации видов Neisseria и их отделения от Moraxella и Kingella дифференциация между N. gonorrhoeae и K. denitrificans , особенно когда штаммы K. denitrificans выглядят как грамотрицательные диплококки в окрашенных мазках.
- Облегчение идентификации видов Corynebacterium
Ограничения
- Тест на восстановление нитратов может использоваться в качестве вспомогательного средства для идентификации бактерий. Для полной идентификации рекомендуется дополнительное биохимическое тестирование с использованием чистой культуры.

- Из-за возможного присутствия нитритов в питательных средах для теста на восстановление нитратов следует использовать среду с низким содержанием нитритов, такую как нитратный агар или нитратный бульон.
- Отрицательный тест на восстановление цинка (без изменения цвета) в сочетании с отрицательной реакцией на нитриты является предполагаемым признаком того, что нитрат восстановился после стадии нитрита. Хотя очень распространенным конечным продуктом восстановления нитритов является газообразный азот, могут образовываться и другие конечные продукты. Для определения конечных продуктов реакции может потребоваться дополнительное тестирование.
- Чтобы избежать ложноотрицательных реакций восстановления нитритов, отрицательные реакции нитритов необходимо подтверждать добавлением в среду цинковой пыли.
- Сообщалось, что избыток цинковой пыли вызывает ложноположительные реакции восстановления нитритов из-за полного восстановления ранее невосстановленных нитратов до аммиака.




 Укажите
Укажите Ука-жите
Ука-жите

 Групповым
Групповым



 )
)
 )
)
 Таким образом, он используется для дифференциации представителей Enterobacteriaceae, которые продуцируют фермент нитратредуктазу, от грамотрицательных бактерий, которые не продуцируют фермент нитратредуктазу.
Таким образом, он используется для дифференциации представителей Enterobacteriaceae, которые продуцируют фермент нитратредуктазу, от грамотрицательных бактерий, которые не продуцируют фермент нитратредуктазу.
