Содержание
Раствор для кладки кирпича, пропорции песка и цемента
Кладочный раствор для обустройства кирпичных сооружений использовался строителями в течение столетий. Такие постройки отличались надежностью и прочностью, а срок их службы превышал 100 лет. Чтобы создать качественную смесь, необходимо подобрать правильные пропорции и соотношение компонентов.
Содержание
- 1 Какой раствор нужен для кладки кирпича
- 2 Виды
- 2.1 Известковый
- 2.2 Цементный
- 2.3 Цементно-известковый
- 2.4 Простая смесь
- 2.5 Сложная смесь
- 3 На что следует обратить внимание
- 3.1 Пропорции
- 3.2 Расчет состава
- 3.3 Контроль качества
- 4 Выполнение замеса
- 5 Определение подвижности
- 6 Важность соблюдения пропорции цемента и песка
Какой раствор нужен для кладки кирпича
Правильно составленные кладочные растворы должны соответствовать следующим нормам:
- Грамотный выбор рецепта раствора для кладки, пропорций песка и цемента и объемов исходного сырья.

- Применение качественных компонентов.
- Тщательная подготовка материалов.
- Соблюдение технологии производства.
Придерживаясь таких требований, можно создать качественный цемент на кирпичную кладку, который будет обладать следующими достоинствами:
- Оптимальная пластичность смеси. Такой параметр способствует эффективному заделыванию углублений в кладочных слоях.
- Время твердения. Большие объемы раствора, который быстро твердеет, непригодны к использованию. Чтобы устранить такое явление, нужно добавить в состав известь.
- Повышенная прочность. Когда смесь застынет, прочностные характеристики цементных слоев будут увеличены, а стена из кирпича станет устойчивой к деформациям и другим негативным факторам.
Чтобы обеспечить эффективное образование твердой ЦПС, нужно грамотно выбрать пропорции раствора. В процессе реакции компонентов с водой увеличиваются прочностные показатели, а связующий компонент объединяет стройматериалы в цельную конструкцию.
Несмотря на используемую рецептуру, кладочный раствор и пропорции песка и цемента должны предусматривать наличие следующих ингредиентов:
- Вяжущая часть. В большинстве случаев применяется цемент для кладки, который начинает твердеть при взаимодействии с жидкостью, соединяясь с остальными частями раствора..
- Вещество-заполнитель. Предназначается для улучшения эксплуатационных свойств и увеличения объема смеси.
- Жидкость. Вода используется для реакции с вяжущей частью добавки и способствует нормальному протеканию гидратации.
Роль вещества с вяжущими свойствами могут выполнять следующие типы сырья:
- Портландцемент.
- Известь.
- Известково-цементная смесь.
Разбираясь, какой цемент лучше для кладки кирпича, необходимо учитывать тип задач, для которых он будет использоваться, и характеристики марки.
Состав для кладки замешивается на базе чистого песка из речки или карьера, не содержащего разные включения, такие как глина, трава или корни.
Чтобы повысить прочность, можно добавить к основе фибру.
Цементный раствор для кладки кирпича должен содержать и дополнительные компоненты, в их числе:
- Добавки для повышения морозостойкости. Их задача заключается в предотвращении кристаллизации жидкости под воздействием мороза и нормализации гидратации.
- Пластифицирующие добавки. Способствуют удобоукладываемости рабочего состава и облегчают его эксплуатацию.
- Отвердители. Улучшают процесс полимеризации вяжущих добавок и уменьшают период набора прочностных показателей.
- Красители. С помощью цветных пигментов можно поменять гамму материала и улучшить эстетические свойства стены.
Конечная марка состава определяется пропорциями песка и цемента для кладки кирпича. По мере увеличения содержания песка марка снижается, а при увеличении доли цемента — повышается. Для замешивания растворов используют разные марки цементной-песчаной смеси для кладки кирпича, но наиболее часто встречается М75. В таком случае пропорции цемента и песка для кладки кирпича выбираются в соотношении 1:5:0,8.
В таком случае пропорции цемента и песка для кладки кирпича выбираются в соотношении 1:5:0,8.
Материалы с маркировкой М75 способствуют надежному связыванию разных типов кирпича и камня, обеспечивая высокую устойчивость построек к негативным воздействиям.
Виды
Кладочный раствор может отличаться разным соотношением ингредиентов. Они выбираются с учетом назначения и сферы применения.
Известковый
Для возведения кирпичных заборов и стеновых конструкций принято использовать растворы для кирпичной кладки с высокой пластичностью. Поэтому в их состав добавляют известь, соединенную с песком. Сухие добавки тщательно перемешиваются, а потом заливаются жидкостью. Дальше ингредиенты еще раз перемешиваются до образования сметанообразной консистенции без комочков и твердых примесей.
Оптимальные пропорции выбираются из расчета 1 часть извести на 2-5 частей песка.
Цементный
Интересуясь, как приготовить раствор для кладки кирпича, пропорции песка и цемента нужно выбирать с учетом некоторых требований.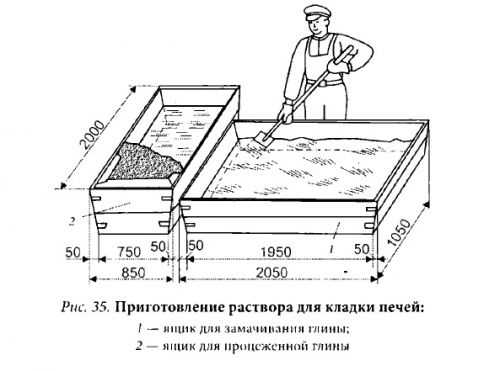 В зависимости от марки второго компонента определяется соотношение ингредиентов: так, на 1 часть цемента может приходится 3-6 частей песка.
В зависимости от марки второго компонента определяется соотношение ингредиентов: так, на 1 часть цемента может приходится 3-6 частей песка.
Сухие добавки соединяются до появления единой массы. В первую очередь нужно замешать сухие ингредиенты, а потом добавить к ним воду. Однако у такого способа имеются недостатки, поскольку совмещение разных марок делает раствор малоподвижным и придает ему высокую жесткость.
Цементно-известковый
Состав кладочного раствора на основе цементно-известковой смеси создается из следующих ингредиентов:
- Гашеная известь, разведенная в воде до густого состояния. Известковую массу тщательно процеживают.
- Сухой цемент на кладку и песок.
Каждая часть тщательно перемешивается. Наличие извести в составе цемента повышает пластичность смеси и позволяет использовать ее с любыми разновидностями кирпичей.
Простая смесь
Простую смесь создают на базе связывающей добавки и песка. В качестве первого может использоваться глина, но такой вариант востребован только для узкопрофильных задач.
Цементно-песчаная консистенция выбирается в пропорции 1:3. Сухие элементы тщательно смешиваются, после чего к ним добавляется вода.
Сложная смесь
Сложным замесом называются составы из разных добавок и вяжущей основы. К таковым относят цементно-известково-глиняные и другие растворы. Наличие глины в составе способствует легкой и аккуратной укладке.
Если необходимо выполнять кладку кирпичных стен фасадной части дома, смесь разбавляют пластификаторами. Такой тип раствора отличается экономичным расходом исходного сырья и ровной укладкой на поверхность.
На что следует обратить внимание
Чтобы разобраться, как рассчитать количество цемента для кладки, необходимо обратить внимание на массу нюансов и факторов, в их числе:
- Пропорции компонентов.

- Расчет количества цемента.
- Контроль качества. Точно определить, сколько цемента нужно внести в состав, несложно. Для этого используются общепринятые технологии.
Пропорции
Из всех вариантов состава кладочного раствора цементный тип считается наиболее востребованным. Готовую сухую смесь можно приобрести в строительном магазине, однако из-за больших расходов на транспортировку многие хозяева отдают предпочтение самостоятельному производству материала. Для определения правильных пропорций, нужно учитывать такие факторы:
- Марка цементной смеси (М400, М500).
- Маркировка ЦПС.
Существуют специализированные сайты, на которых размещены вспомогательные таблицы, с помощью которых можно быстро найти приблизительное соотношение ингредиентов для каждой марки.
Так, если нужно подготовить 1 м³ раствора марки 75 (цифровое значение указывает на допустимую нагрузку на 1 см²), следует руководствоваться таким расчетом:
- 220 кг цемента М500 и песка в пропорции 1:6,7.

- 270 кг цемента М400 смешивается с песком в соотношении 1:5,4.
- 360 кг цемента марки М300 перемешивается с песком в пропорции 1:4,2.
С целью экономии производства некоторые хозяева отклоняются от заданных рекомендаций. Но такой подход ухудшает прочность и эксплуатационные свойства кирпичной постройки.
Расчет состава
Кладочные растворы для кирпича рассчитываются по разным технологиям, но есть нормативные значения объема материала для стен с разным диаметром:
- Если толщина стены составляет 1 кирпич, понадобится 65 л смеси для обустройства 1 кв. м ее поверхности.
- При толщине 1,5 кирпича расход увеличивается до 100 л.
Пропорционально растет объем раствора для стен в 2 или 2,5 кирпича.
Если овладеть методикой расчета, выбор соотношения песка и цемента для кладки кирпича станет максимально простым:
- В первую очередь нужно оценить объем кладки, умножив периметр постройки на высоту и толщину стен.
- От полученных результатов отнимается число объема окон и дверей.

- Дальше рассчитывается количество кубов с умножением объема стен на 0,2-0,3.
Контроль качества
Если покупается готовый материал, то он должен поставляться с соответствующей документацией, где указана дата производства, марка и подвижность. Любой состав должен обладать оптимальными прочностными свойствами, плотностью и подвижностью.
При оценке качества самодельной продукции нужно руководствоваться такими принципами:
- Подвижность оценивается путем помещения смеси в емкость с раствором эталонного конуса. Глубина погружения конуса будет указывать на подвижность.
- Для определения плотности смеси нужно взвесить сосуд и поделить массу на объем раствора.
Выполнение замеса
Для проведения замеса ЦПС можно использовать следующие приспособления:
- Бетономешалка.
- Строительный миксер.
- Совковая лопата.
Важно учитывать, что смесь можно применять по назначению только в течение первого часа. В противном случае она затвердеет и станет непригодной для эксплуатации.
В противном случае она затвердеет и станет непригодной для эксплуатации.
С целью экономии материалов нужно грамотно рассчитывать объемы раствора, чтобы рационально использовать состав. В зависимости от этапа выполнения ремонтных или строительных работ ЦПС разбавляют до правильной консистенции.
При необходимости выполнить оштукатуривание поверхности раствору придают эластичность и очищают от комков или абразивных частиц. Нередко используется цементно-известковый состав, которому свойственна практичность.
Универсальные смеси востребованы для следующих задач:
- Заливка бетоном основы.
- Возведение помещений разной сложности.
- Оштукатуривание.
- Кладочные работы.
- Заделка швов, пустот и трещин.
Внесение в состав дополнительных компонентов способствует появлению таких эксплуатационных преимуществ:
- Устойчивость к износу.
- Водостойкость.
- Устойчивость к отрицательным температурам.
- Прочность.

- Надежность.
- Долговечность.
- Высокие адгезионные свойства.
Определение подвижности
Поскольку подвижность состава является одной из ключевых характеристик, ее нужно измерять с высокой точностью. Чтобы проверить раствор на соответствие оптимальной подвижности, нужно задействовать конус с углом 30°, высотой 15 см и массой 300 г. Конус помещается в раствор, а отметка, где он застынет, будет указывать на степень подвижности.
Существуют разные принципы, которых нужно придерживаться при выборе оптимальной подвижности:
- Для полнотелых кирпичей применяют раствор с подвижностью 9-13 см.
- Пустотелый кирпич должен обладать значением 7-8 см.
- При проведении ремонтно-строительных работ в жаркий период понадобится использовать смесь с показателями 12-14 см.
Важность соблюдения пропорции цемента и песка
Соблюдение правильных пропорций является ключевым залогом прочной и надежной кладки при строительстве, в том числе и в Москве. Если придерживаться рекомендаций и учитывать технологию монтажа, конструкция из кирпичей будет максимально прочной и устойчивой к большим нагрузкам
Если придерживаться рекомендаций и учитывать технологию монтажа, конструкция из кирпичей будет максимально прочной и устойчивой к большим нагрузкам
Раствор для кладки печи из кирпича своими руками – основные составы и пропорции
Важный этап в постройке печки для деревенского дома или бани – приготовление надежного кладочного раствора.
Правильно замешанный раствор для кладки печи влияет на герметичность, долговечность, термостойкость и безопасность готовой конструкции.
Хорошая смесь для кладки печи устойчива к высоким температурным режимам, механическим повреждением и растрескиванию.
Содержание статьи
- Особенности выбора материала
- На основе глины
- Способ №1
- Способ №2
- Способ №3
- Способ №4
- На основе извести
- На основе цемента
Особенности выбора материала
Процесс возведения современных печей разделен на несколько этапов:
- Первый этап – обустройство печного фундамента при помощи бетонного состава;
- Второй этап – кладка печи из огнеупорного кирпича с использованием кладочной соединительной массы на основе глины;
- Третий этап – облицовка печи штукатурным составом.

Наиболее важным является этап непосредственной кладки и приготовление надежной основы, которая должна обладать высокими эксплуатационными характеристиками – жаростойкостью, адгезией, водонепроницаемостью, прочностью и долговечностью.
Для обустройства современных печей применяется несколько вариантов кладочных растворов: глиняный, известковый и цементный.
Кладочные растворы бывают простыми и сложными. Простые состоят из одного вида вяжущего компонента и заполнителя; сложные смеси включают от двух и более вяжущих материалов и несколько заполнителей. Вяжущие компоненты – известь, глина и цемент.
Чтобы приготовить раствор для выполнения кирпичной кладки потребуются следующие инструменты:
- Миксер;
- Емкость для замеса;
- Сито;
- Кельма;
- Мастерок;
- Пластиковый шпатель;
- Строительный термометр;
- Весы.
На основе глины
Один из самых дешевых и доступных типов соединительных печных смесей. Глиняный раствор для кладки печей характеризуется повышенной жирностью, которая определяет степень пластичность, жаростойкости и прочности готового материала.
Глиняный раствор для кладки печей характеризуется повышенной жирностью, которая определяет степень пластичность, жаростойкости и прочности готового материала.
Раствор для печи из натуральной глины бывает:
- Жирный – отличается пластичностью, прочностью, но быстрым появлением трещин после высыхания;
- Нормальный – достаточно пластичен и устойчив к растрескиванию, дает небольшой процент усадки после сушки. Способен выдерживать высокие температуры до 110 градусов;
- Тощий – непластичен и недолговечен, восприимчив к быстрому расслаиванию и крошению.
Огнеупорный раствор из глины готовится на основании трех компонентов: глины, песка и воды. Подобный состав устойчив к растрескиванию и пересыханию, обеспечивает надежное обустройство печи из кирпича.
Чтобы построить печник, рекомендуется использовать жирные и нормальные составы, которые обладают повышенной прочностью, пластичностью и устойчивостью к расслаиванию.
Качество глины определяет количество песка, необходимого для замеса раствора. Для работ используется глина и очищенная вода с низким содержанием примесей. Для кладки 100 кирпичей в среднем используется до 20 литров чистой воды.
Для работ используется глина и очищенная вода с низким содержанием примесей. Для кладки 100 кирпичей в среднем используется до 20 литров чистой воды.
Для приготовления раствора используется карьерный или речной песок мелкой фракции без дополнительных примесей. Перед использованием его обязательно просеивают через мелкоячеистое сито. Если в нем имеются примеси гравия, тогда рекомендуется использовать сито с размером ячеек до 10 мм. Для мелкофракционного материала подойдет сито с 2 мм ячейками.
Перед добавлением других компонентов глиняную основу рекомендуется проверить на пластичность. Как сделать подобную проверку? Для этого небольшую доску следует опустить в полученную смесь для кладки печи и определить ее толщину. Она должна быть в меру густой и тягучей. Если имеется лишняя жидкость, тогда стоит добавить немного вяжущего компонента, периодически размешивая и тестируя смесь на пластичность.
Оптимальная толщина соединительного материала – 2 мм, что свидетельствует о правильном соблюдении пропорций всех компонентов. Готовая кладочная масса получается тягучей и не очень плотной.
Готовая кладочная масса получается тягучей и не очень плотной.
Подходящая плотность раствора для кладки зависит от соотношения основных компонентов в ней – глины и песка соответственно:
- Жирная масса – 1:2;
- Нормальная масса – 1:1;
- Тощая масса – 2:1.
Способы приготовления глиняного состава
Как приготовить качественную соединительную массу на основе глины? Существует несколько проверенных способов.
Способ №1
Нужный объем глины замачивается на 24 часа, добавляется вода для получения густой массы. Полученный материал аккуратно процеживается, затем в него добавляется песок и еще раз замешивается. Важно избегать образования глинистых луж, которые можно устранить небольшой порцией вяжущего компонента.
Способ №2
В емкости соединяется шамотный песок и глина в равных пропорциях, добавляется очищенная вода (1/4 часть от объема глины). Все компоненты тщательно перемешиваются до получения однородной массы.
Способ №3
Состав замешивается на основе суглинков. Этот рецепт предусматривает приготовление 10 различных вариантов раствора, из которого выбирается лучший.
Этот рецепт предусматривает приготовление 10 различных вариантов раствора, из которого выбирается лучший.
Для первого: 10 объемов суглинки, 1 объем песка и 1 объем цемента и т.д. по убыванию объема суглинки. Десять полученных основ помещаются в разные емкости и оставляются на просушку в течение 5-6 дней. По завершению отведенного времени определяется наиболее качественный состав раствора с минимальной степенью усадки и устойчивостью к растрескиванию.
Способ №4
К глине добавляется песок и ¼ воды. Все компоненты перемешиваются для получения густой тягучей массы. Для повышения прочности в подобную смесь рекомендуется добавить каменной соли или цемента. На ведро смеси – до 250 г соли и ¾ литра цемента. Соль предварительно растворяют в воде, а цемент разводят водой до густой консистенции, после чего добавляют в готовую основу.
На основе извести
Для строительства фундамента и печного дымохода рекомендуется использовать состав на основе извести и цемента.
Особое тесто, получаемое путем смешивания негашеной извести и воды в соотношении 3:1. В готовое тесто добавляется просеянный песок через мелкоячеистое сито в соотношении 3:1 – на 3 объема песка 1 объем теста. Готовая масса разбавляется водой до получения густой массы.
В готовое тесто добавляется просеянный песок через мелкоячеистое сито в соотношении 3:1 – на 3 объема песка 1 объем теста. Готовая масса разбавляется водой до получения густой массы.
Смесь для кладки печи на основе извести получается достаточно пластичной и прочной.
Показатель жирности состава из извести определяется количеством песка. Для чрезмерно жирной смеси требуется 5 объемов песочной составляющей, для нормальной – не более 3 объемов.
Увеличить прочность и водостойкость можно путем добавления цемента. Для приготовления подобного состава необходимо использовать компоненты в таких пропорциях (части):
- Цемент – 1;
- Песок – 10;
- Известковое тесто – 2.
Приготовление раствора имеет такую последовательность действий: цементные и песочные компоненты соединяются в отдельной емкости. Готовое тесто на основе извести разбавляют очищенной водой до получения густой консистенции. В разведенное тесто вводят сыпучие компоненты и перемешивают. Для увеличения вязкости, состав разбавляют водой.
На основе цемента
Какой раствор нужен для обустройства печного фундамента и кладки наружной части дымоходной трубы? Ответ прост – состав на основе цемента, песка и воды. По своей прочности он равен известковому аналогу, но для затвердения требует гораздо больше времени.
Оптимальный состав готовой массы получается в следующих пропорциях – 3:1 (на 3 объема песка 1 объем цемента марки М 300 или 400). Перед смешиванием все компоненты просеиваются через мелкоячеистое сито. В глубокую емкость засыпается просеянный песок, добавляется цемент и перемешиваются до однородной массы. В конце добавляется вода.
Готовую смесь нужно довести до густой и тягучей консистенции. Определить подходящую густоту достаточно просто – состав должен оставаться подвижным, но при этом не стекать с лопаты при ее повороте до 45 градусов.
Чтобы возвести монолитный печник, рекомендуется использовать огнеупорную бетонную смесь в следующих пропорциях (части):
- Цемент (М 400) – 1;
- Щебень или гравий – 2;
- Мелкозернистый песок – 2;
- Песок из шамота – 0,4.

Чтобы печник имел прочный фундамент, рекомендуется подготовить раствор для кладки, состоящий из крупно фракционного гравия, песка, цемента (пропорции 3:3:1).
Для увеличения прочности можно использовать кварцевую крошку. Огнеупорная бетонная смесь получается крупно фракционной, повышенной плотности и водонепроницаемости.
Для правильного замеса на 25 кг готовой смеси требуется 10 литров воды. Оптимальный способ смешивания – механический при помощи бетономешалки. Готовый состав застывает быстро, поэтому рекомендуется использовать его сразу после приготовления.
Строительство печи имеет свои отличительные особенности в отношении правильного выбора состава и приготовления кладочного раствора. Для разных элементов конструкции используются различные составы.
5.2: Растворы и разведения — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98550
Цели обучения
- Количественно описать концентрации растворов
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора — это количество растворенного вещества , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора — это количество растворенного вещества , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (М) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора. Это эквивалентно количеству миллимолей растворенного вещества, присутствующего ровно в 1 мл раствора:
\[ молярность = \dfrac{моли\: of\: растворенное вещество}{литры\: of\: раствора} = \dfrac{mmoles \: of\: раствор} {миллилитров\: of\: раствор} \label{4.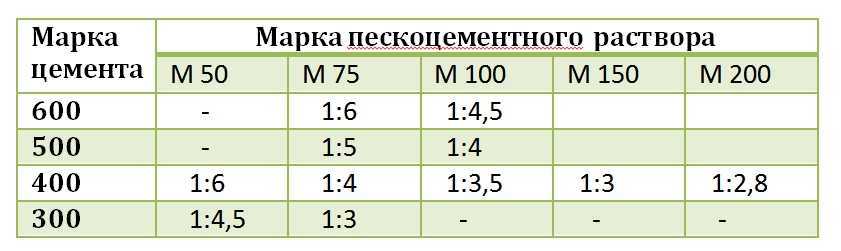 5.1} \]
5.1} \]
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно \(М\). Водный раствор, содержащий 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
\[[\rm{сахароза}] = 1,00\: M \номер \]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \label{4.5.2} \]
или
\[ V_{мл} M_{ммоль/мл} = \cancel{мл} \left( \dfrac{ммоль} {\cancel{мл}} \right) = ммоль \label{4.5.3} \]
На рисунке \(\PageIndex{1}\) показано использование уравнений \(\ref{4.5.2}\) и \(\ref{4.5.3}\).
Рисунок \(\PageIndex{1}\): Приготовление раствора известной концентрации с использованием твердого растворенного вещества
Пример \(\PageIndex{1}\): Расчет молей по концентрации NaOH
Рассчитайте количество молей гидроксида натрия (NaOH) в 2,50 л 0,100 М NaOH.
Дано: идентичность растворенного вещества, объем и молярность раствора
Запрошено: количество растворенного вещества в молях
Стратегия:
Используйте либо уравнение \ref{4.5.2}, либо уравнение \ref{4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
Решение:
Поскольку нам дан объем раствора в литрах и задано количество молей вещества, уравнение \ref{4.5.2} более полезно:
\( моль\: NaOH = V_L M_{моль/л} = (2,50\: \отменить{L}) \влево(\dfrac{0,100\: моль} {\отменить{L}} \вправо) = 0,250\: моль\: NaOH \)
Упражнение \(\PageIndex{1}\): Расчет молей по концентрации аланина
Рассчитайте количество миллимолей аланина, биологически важной молекулы, в 27,2 мл 1,53 М аланин.
- Ответить
41,6 ммоль
Расчеты с использованием молярности (M): Расчеты с использованием молярности (M), YouTube(opens in new window) [youtu. be]
be]
Концентрации также часто указываются в пересчете на массу (м/м) или на основе массы на объем (м/об), особенно в клинических лабораториях и инженерных приложениях. Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или частей на миллиард ( частей на миллион ), что составляет граммов растворенного вещества на 10 9 г раствора. решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
| Концентрация | Единицы |
|---|---|
| м/м | г растворенного вещества/г раствора |
| т/х | г растворенного вещества/мл раствора |
| частей на миллион | г растворенного вещества/10 6 г раствора |
| мкг/мл | |
| частей на миллиард | г растворенного вещества/10 9 г раствора |
| нг/мл |
Приготовление растворов
Для приготовления раствора, содержащего определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора. На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок \(\PageIndex{2}\): Приготовление 250 мл раствора (NH 4 ) 2 Cr 2 O 7 в воде. Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды. 45 мл воды остается в мерном цилиндре даже после добавления до метки мерной колбы.
Пример \(\PageIndex{2}\)
Раствор содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 • 2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти число молей \(\ce{CoCl2•2h3O}\), разделите масса соединения по его молярной массе. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 •2H 2 O составляет 165,87 г/моль. Следовательно,
\[ моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /mol} \right) = 0,0603\: моль \номер \]
Объем раствора в литрах равен
\[ объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0,500\: L \nonumber \]
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\[ молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \номер\]
Упражнение \(\PageIndex{2}\)
Раствор, показанный на рисунке \(\PageIndex{2}\), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 дюймов достаточное количество воды, чтобы получить окончательный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Какова молярная концентрация дихромата аммония?
- Ответить
\[(NH_4)_2Cr_2O_7 = 1,43\: М \номер\]
Чтобы приготовить определенный объем раствора, который содержит указанную концентрацию растворенного вещества, нам сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \(\ref{4.5.2 }\). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \(\PageIndex{3}\).
Пример \(\PageIndex{3}\): Раствор D5W
Так называемый раствор D5W, используемый для внутривенного замещения жидкостей организма, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в указанном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив число молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \right) = 27,9 \: g \: глюкоза \)
Упражнение \(\PageIndex{3}\)
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
- Ответить
2,3 г NaCl
Раствор нужной концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод, взвешивающий крошечные количества растворенного вещества, трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рисунке \(\PageIndex{3}\). Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества основного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0036
Помните, что разбавление заданного количества основного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0036
\[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\метка{4.5.4} \]
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример \(\PageIndex{4}\) демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок \(\PageIndex{3}\): Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий требуемые моли растворенного вещества (M s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример \(\PageIndex{4}\)
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере \(\PageIndex{3}\)?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора раствор по его молярности.
Решение:
A Раствор D5W в примере 4.5.3 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\[ моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \номер \]
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего такое количество глюкозы:
\[объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \не число \]
При определении необходимого объема исходного раствора мы должны были разделить желаемое число молей глюкозы по концентрации исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли решить эту задачу за один шаг, решив уравнение 4.5.4 для V s и подставив соответствующие значения:
\[ V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2.500\: L)(0.310\: \cancel{M})} {3.00\: \cancel{M}} = 0.258\: L \nonumber \]
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение \(\PageIndex{4}\)
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответить
16 мл
Концентрация ионов в растворе
В примере \(\PageIndex{2}\) концентрация раствора, содержащего 90,00 г бихромата аммония в конечном объеме 250 мл, рассчитана как 1,43 М. Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля Cr 2 O 7 2 − анионов и 2 моль катионов NH 4 + (см. рисунок \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Растворение 1 моль ионного соединения. В этом случае при растворении 1 моля (NH 4 ) 2 Cr 2 O 7 получается раствор, содержащий 1 моль Cr 2 O 7 2 − ионов и 2 моль NH 4 + ионов. (Молекулы воды для ясности не показаны на молекулярном изображении раствора.) 1 моль дихромата аммония показан в мерной колбе объемом 1 л. Полученная мерная колба справа содержит 1 литр раствора после растворения в воде. Порошкообразная форма бихромата аммония также включена в схему.
При проведении химической реакции с использованием раствора соли, такой как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 CR 2 O 7 , затем концентрация CR 2 O 7 2 — также должен быть 1,43 M, потому что есть один CR 9019 . 9015 9015 9015 9015 9015 9015 9015 9015 9015 .  в растворе 3 × 1,43 M = 4,29 M.
в растворе 3 × 1,43 M = 4,29 M.
Концентрация ионов в растворе из растворимой соли: концентрация ионов в растворе из растворимой соли, YouTube (opens in new window) [youtu.be]
Пример \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (CH 3 ) 2 CHOH
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. — (водн.) \)
— (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
9- (водн.) \)
B Одна формула единицы в IN (№ 3 ) 3 производит один в 3 + Ион и три № 3 — Ион. 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 м = 0,096 м № 3 — — это, [в 3 + ] = 0,032 м. − ] = 0,096 М.
− ] = 0,096 М.
Упражнение \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Резюме
Концентрации растворов обычно выражаются в молях и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
- определение молярности: \[ молярность = \dfrac{моли\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитры\: из \: решение} \номер \]
- связь между объемом, молярностью и молями : \[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \nonumber \ ]
- связь между объемом и концентрацией основного и разбавленного растворов : \[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d) \номер\]
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора.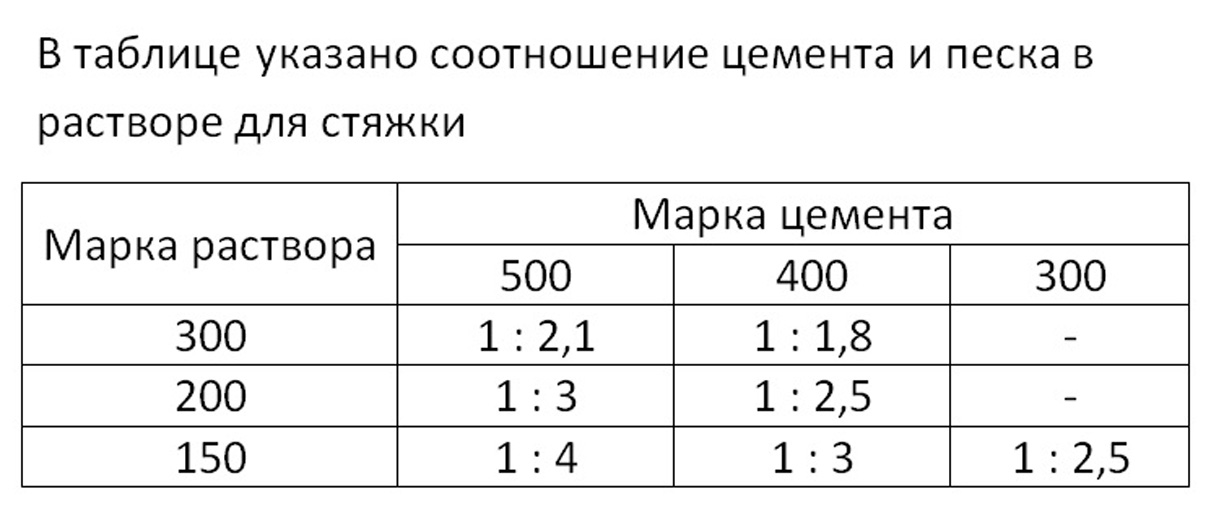 Концентрации обычно выражают в терминах молярности , определяемой как число молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо растворением известной массы растворенного вещества в растворителе и разбавлением до желаемого конечного объема, либо разбавлением соответствующего объема более концентрированного раствора (исходный раствор 9).0033 ) до желаемого конечного объема.
Концентрации обычно выражают в терминах молярности , определяемой как число молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо растворением известной массы растворенного вещества в растворителе и разбавлением до желаемого конечного объема, либо разбавлением соответствующего объема более концентрированного раствора (исходный раствор 9).0033 ) до желаемого конечного объема.
Авторы и авторство
5.2: Solutions and Dilutions распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип артикула
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
2.5: Подготовка растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 127138
- Дэвид Харви
- Университет ДеПау
Приготовление раствора известной концентрации, пожалуй, самое распространенное занятие в любой аналитической лаборатории. Метод измерения растворенного вещества и растворителя зависит от желаемой концентрации и от того, насколько точно необходимо знать концентрацию раствора. Пипетки и мерные колбы используются, когда нам нужно знать точную концентрацию раствора; градуированные цилиндры, мензурки и/или бутыли с реагентами достаточны, когда концентрация должна быть только приблизительной. В этом разделе описаны два метода приготовления растворов.
Пипетки и мерные колбы используются, когда нам нужно знать точную концентрацию раствора; градуированные цилиндры, мензурки и/или бутыли с реагентами достаточны, когда концентрация должна быть только приблизительной. В этом разделе описаны два метода приготовления растворов.
Приготовление основных растворов
Основной раствор готовят путем взвешивания соответствующей части чистого твердого вещества или путем отмеривания соответствующего объема чистой жидкости, помещения его в подходящую колбу и разбавления до известного объема. . То, как именно измеряется реагент, зависит от желаемой единицы концентрации. Например, для приготовления раствора с известной молярностью отвешивают соответствующую массу реагента, растворяют его в порции растворителя и доводят до нужного объема. Чтобы приготовить раствор, в котором концентрация растворенного вещества является объемным процентом, вы отмеряете соответствующий объем растворенного вещества и добавляете достаточное количество растворителя, чтобы получить желаемый общий объем.
Пример 2.5.1
Опишите, как приготовить следующие три раствора: (a) 500 мл примерно 0,20 М NaOH с использованием твердого NaOH; (b) 1 л 150,0 ppm Cu 2 + с использованием металлической меди; и (c) 2 л 4% по объему уксусной кислоты с использованием концентрированной ледяной уксусной кислоты (99,8% по весу уксусной кислоты).
Раствор
(a) Поскольку желаемая концентрация известна с точностью до двух значащих цифр, нам не нужно точно измерять массу NaOH или объем раствора. Желаемая масса NaOH равна
\[\frac {0,20 \text{ моль NaOH}} {\text{L}} \times \frac {40,0 \text{г NaOH}} {\text{моль NaOH}} \times 0,50 \text{L} = 4,0 \text{ г NaOH} \номер\]
Для приготовления раствора поместите 4,0 грамма NaOH, взвешенных с точностью до десятых долей грамма, в бутылку или химический стакан и добавьте примерно 500 мл воды.
(b) Поскольку искомая концентрация Cu 2 + задается четырьмя значащими цифрами, мы должны точно измерить массу металлической Cu и объем конечного раствора. Желаемая масса металлической меди
Желаемая масса металлической меди
\[\frac {150,0 \text{мг Cu}} {\text{L}} \times 1,000 \text{ M } \times \frac {1 \text{г}} {1000 \text{мг}} = 0,1500 \text{г Cu} \номер\]
Для приготовления раствора отмерьте ровно 0,1500 г меди в небольшой химический стакан и растворите его, используя небольшую порцию концентрированной HNO 3 . Для обеспечения полного переноса Cu 2 + из стакана в мерную колбу — то, что мы называем количественным переносом — несколько раз промыть химический стакан небольшими порциями воды, добавляя при каждой промывке мерную колбу. . Наконец, добавьте еще воды до калибровочной отметки на мерной колбе.
(c) Концентрация этого раствора является приблизительной, поэтому нет необходимости точно измерять объемы, а также нет необходимости учитывать тот факт, что ледяная уксусная кислота представляет собой немного менее 100% уксусной кислоты по весу (это приблизительно 99,8% вес./вес. ). Необходимый объем ледяной уксусной кислоты
). Необходимый объем ледяной уксусной кислоты
\[\frac {4 \text{ мл } \ce{Ch4COOH}} {100 \text{ мл}} \times 2000 \text{ мл} = 80 \text{ мл } \ce{Ch4COOH} \nonumber\]
Чтобы приготовить раствор, используйте градуированный цилиндр, чтобы перенести 80 мл ледяной уксусной кислоты в контейнер, вмещающий примерно 2 л, и добавить достаточное количество воды, чтобы довести раствор до желаемого объема.
Упражнение 2.5.1
Предоставьте инструкции по приготовлению 500 мл 0,1250 М KBrO 3 .
- Ответить
Приготовление 500 мл 0,1250 М KBrO 3 требуется
\[0,5000 \text{ L} \times \frac {0,1250 \text{ моль } \ce{KBrO3}} {\text{L}} \times \frac {167,00 \text{ г } \ce{KBrO3}} {\text{моль} \ce{KBrO3}} = 10,44 \text{г} \ce{KBrO3} \nonumber\]
Поскольку концентрация имеет четыре значащих цифры, мы должны приготовить раствор, используя мерную посуду. Поместите 10,44 г образца KBrO 3 в мерную колбу вместимостью 500 мл и частично заполнить водой.
 Встряхните, чтобы растворить KBrO 3 , а затем разбавьте водой до калибровочной метки на колбе.
Встряхните, чтобы растворить KBrO 3 , а затем разбавьте водой до калибровочной метки на колбе.
Приготовление растворов путем разбавления
Растворы часто готовят путем разбавления более концентрированного маточного раствора. Известный объем маточного раствора переносят в новую емкость и доводят до нового объема. Поскольку общее количество растворенного вещества до и после разбавления одинаково, мы знаем, что
\[C_o \times V_o = C_d \times V_d \label{2.1}\]
где \(C_o\) — концентрация исходного раствора, \(V_o\) — объем разбавляемого исходного раствора, \( C_d\) — концентрация разбавленного раствора, а \(V_d\) — объем разбавленного раствора. Опять же, тип стеклянной посуды, используемой для измерения \(V_o\) и \(V_d\), зависит от того, насколько точно нам нужно знать концентрацию раствора.
Обратите внимание, что уравнение \ref{2.1} применяется только к тем единицам концентрации, которые выражены в терминах объема раствора, включая молярность, формальность, нормальность, объемные проценты и весовые проценты по объему. Это также относится к массовым процентам, частям на миллион и частям на миллиард, если плотность раствора составляет 1,00 г/мл. Мы не можем использовать уравнение \ref{2.1}, если мы выражаем концентрацию с точки зрения моляльности, так как это основано на массе растворителя, а не на объеме раствора. См. Родрикес-Лопес, М.; Карраскильо, А. J. Chem. Образовательный 2005 , 82 , 1327-1328 для дальнейшего обсуждения.
Это также относится к массовым процентам, частям на миллион и частям на миллиард, если плотность раствора составляет 1,00 г/мл. Мы не можем использовать уравнение \ref{2.1}, если мы выражаем концентрацию с точки зрения моляльности, так как это основано на массе растворителя, а не на объеме раствора. См. Родрикес-Лопес, М.; Карраскильо, А. J. Chem. Образовательный 2005 , 82 , 1327-1328 для дальнейшего обсуждения.
Пример 2.5.2
Лабораторная процедура требует 250 мл примерно 0,10 М раствора NH 3 . Опишите, как вы приготовите этот раствор, используя исходный раствор концентрированного NH 3 (14,8 М).
Раствор
Подстановка известных объемов в уравнение \ref{2.1}
\[14,8 \text{ M} \times V_o = 0,10 \text{ M} \times 250 \text{ мл} \nonumber\]
и решение для \(V_o\) дает 1,7 мл. Поскольку мы готовим раствор с концентрацией приблизительно 0,10 М NH 3 , мы можем использовать градуированный цилиндр для измерения 1,7 мл концентрированного NH 3 , перенести NH 3 в химический стакан и добавить достаточное количество воды, чтобы получить общий объем около 250 мл.
Хотя обычно мы выражаем молярность как моль/л, мы можем выразить объемы в мл, если сделаем это как для \(V_o\) , так и для \(V_d\).
Упражнение 2.5.2
Для приготовления стандартного раствора Zn 2 + образец цинковой проволоки массой 1,004 г растворяют в минимальном количестве HCl и доводят до метки в мерной колбе вместимостью 500 мл. Если вы разбавите 2000 мл этого исходного раствора до 250,0 мл, какова будет концентрация Zn 2 + в мкг/мл в вашем стандартном растворе?
- Ответить
Первый раствор представляет собой маточный раствор, который мы затем разбавляем для приготовления стандартного раствора. Концентрация Zn 9{2+}}} {\text{мл}} \times 2,000 \text{мл} = C_d \times 250,0 \text{мл} \nonumber\]
, где C d — концентрация стандартного раствора. Решение дает концентрацию 16,06 мкг Zn 2 + /мл.

Как показано в следующем примере, мы можем использовать уравнение \ref{2.1} для расчета исходной концентрации раствора, используя его известную концентрацию после разбавления.
Пример 2.5.3
Образец руды был проанализирован на Cu 2 + следующим образом. Навеску руды массой 1,25 г растворяли в кислоте и доводили до нужного объема в мерной колбе вместимостью 250 мл. 20 мл полученного раствора пипеткой переносили в мерную колбу вместимостью 50 мл и доводили до метки. Анализ этого раствора дает концентрацию Cu 2 + 4,62 мкг/мл. Какова массовая доля меди в исходной руде?
Решение 9{2+}} \номер\]
Эта страница под заголовком 2.5: Preparing Solutions распространяется по лицензии CC BY-NC-SA, автором, ремиксом и/или куратором этой страницы является Дэвид Харви.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Дэвид Харви
- Тип страницы
- Аналитическая химия
- Лицензия
- CC BY-NC-SA
- Показать страницу TOC
- № на стр.



 Чтобы повысить прочность, можно добавить к основе фибру.
Чтобы повысить прочность, можно добавить к основе фибру.






 Встряхните, чтобы растворить KBrO 3 , а затем разбавьте водой до калибровочной метки на колбе.
Встряхните, чтобы растворить KBrO 3 , а затем разбавьте водой до калибровочной метки на колбе.
