Содержание
Какой объем раствора с массовой долей серной кислоты 60% и раствора с массовой долей серной кислоты 30 % надо взять для приготовления 240 г раствора с массовой долей кислоты 50%?
8 класс
Какой объем раствора с массовой долей серной кислоты 60% ($\rho_{1} = 1,5 г/мл$) и раствора с массовой долей серной кислоты 30 % ($\rho_{2} = 1,2 г/мл$) надо взять для приготовления 240 г раствора с массовой долей кислоты 50%?
$\omega_{см}(H_{2}SO_{4} ) = \frac{m_{1}(р-ра) \cdot \omega_{1}(H_{2}SO_{4} ) + m_{2}(р-ра) \cdot \omega_{2}(H_{2}SO_{4} )}{m_{1}(р-ра) + m_{2}(р-ра) }$.
Обозначим массу 60%-го раствора через $x$, а массу 30%-го раствора через $(240 — x)$, тогда
$0,5 = \frac{0,6x + 0,3(240 — x) }{x + (240 — x) }$ или $0,3x = 48$;
$x = \frac{48}{0,3} = 160 г$.
Следовательно, $V_{1} = \frac{m_{1}(р-ра) }{ \rho_{1} } = \frac{160 г}{1,5 г/мл} = 107 мл$ (60%-го раствора).
$m_{2}(р-ра) = 240 — 160 = 80 г; m_{2}(р-ра) = V_{2} \cdot \rho_{2}$,
откуда $V_{2} = \frac{m_{2}(р-ра) }{ \rho_{2} } = \frac{80 г}{1,2 г/мл} = 66,7 мл$ (30%-го раствора). {\circ} С$ равно 17 мм рт. ст.). Высота столба воды в эвдиометре 46,2 см. Неизвестное вещество реагирует с щелочными металлами и не реагирует с щелочами.
{\circ} С$ равно 17 мм рт. ст.). Высота столба воды в эвдиометре 46,2 см. Неизвестное вещество реагирует с щелочными металлами и не реагирует с щелочами.
а. Какова молекулярная масса исследуемого вещества, если известно, что плотность его паров по воздуху равна 1,11?
б. Из каких веществ получают данное соединение и какой объем этих веществ, измеренный при нормальных условиях, потребуется для получения 5 молей исследуемого органического вещества?
8 класс
Химия
Средняя
13
На нейтрализацию водного раствора, образовавшегося при гидролизе 1,000 г некоторого ангидрида $X$, было израсходовано 22,73 мл одномолярного раствора $NaOH$. Определите строение органического соединения $X$ и предложите метод его получения из неорганических веществ.
8 класс
Химия
Средняя
15
К 200 г 10 %-ного раствора $KCl$ добавили 50 г воды. Чему равна массовая доля $KCl$ в полученном растворе?
Чему равна массовая доля $KCl$ в полученном растворе?
8 класс
Химия
Средняя
21
Если материал понравился Вам и оказался для Вас полезным, поделитесь им со своими друзьями!
Какой объем раствора серной кислоты нужен?? § 17-18, задача 2. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/класс
Какой объем раствора серной кислоты нужен?? § 17-18, задача 2. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/класс
Интересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
И вот эту задачу еще не могу сам решить ->> Какой объем 20%-ного раствора серной кислоты (плотность 1,14 г/мл) необходим для нейтрализации 100 мл 6%-ного раствора карбоната натрия (плотность 1,06 г/мл)?
Лучший ответ
Привет, там несложно
Na2CO3+H2SO4=> H2CO3+ Na2SO4
V (Na2CO3) = 6мл
m (Na2CO3) = 6*1,06 = 6. 36г
36г
кол. вещ-ва (Na2CO3) = m/М = 6,36/106 = 0,06моль
кол. вещ-ва (H2SO4) = кол. вещ-ва (Na2CO3) = 0,06моль
m (H2SO4) = 0,06*98 = 5,88г
V (H2SO4) = 5,88/1,14 = 5,16мл
20% = 5,16мл
100% = х
х = 25,8мл
Ответ: 25,8 мл 20%-ного раствора серной кислоты
еще ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.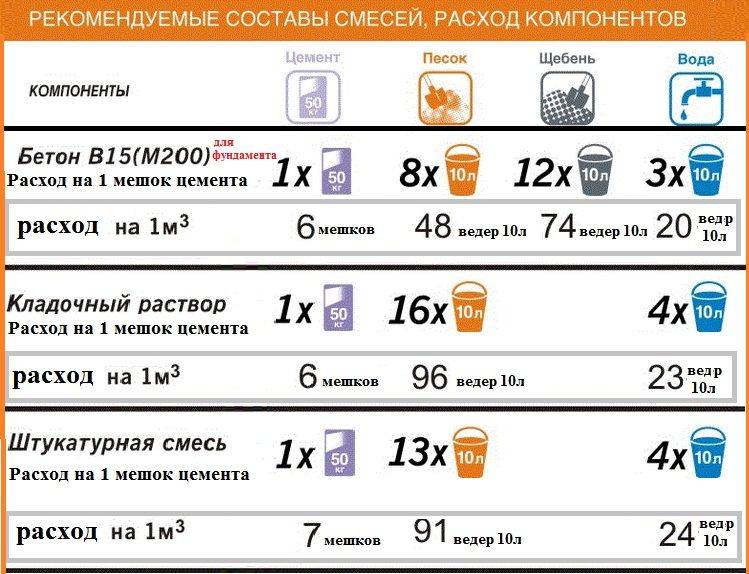 Е.
Е.
Здравствуйте.
(Подробнее…)
Химия
Какой был проходной балл в вузы в 2017 году?
Какой был средний балл ЕГЭ поступивших в российские вузы на бюджет в этом году? (Подробнее…)
Поступление11 классЕГЭНовости
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И. П.
П.
7.14: Концентрации: Объемные проценты — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 222384
Цели обучения
- Рассчитайте объемный процент раствора.
Как указывалось ранее, химики определили несколько типов концентраций, в каждом из которых используется отдельная химически приемлемая единица или комбинация единиц для обозначения количества растворенного вещества, растворенного в заданном количестве растворителя. В следующих параграфах будут представлены и применены уравнения, которые используются для расчета объемного процента, который является вторым из трех процентных концентраций, которые будут обсуждаться в этой главе.
Уравнения объемного процента и слова-индикаторы
объемных процента раствора определяется как отношение объема растворенного вещества, присутствующего в растворе, к объему раствора в целом. Кроме того, поскольку этот тип концентрации, который обычно рассчитывается для растворов в жидкой и газовой фазах, выражается в процентах, эту пропорцию необходимо умножить на 100, как показано ниже.
\(\text{Объемный процент}\) = \( \dfrac{ \rm{V_{раствор} \; (\rm{мл})}}{\rm{V_{раствор} \; (\rm{ мл})}} \) × \({100}\)
Поскольку раствор состоит как из растворенного вещества, так и из растворителя, объем раствора в целом равен сумме объемов растворенного вещества и содержащегося в нем растворителя. Следовательно, следующее уравнение также можно использовать для расчета объемного процента раствора.
\(\text{Объемный процент}\) = \( \dfrac{ \rm{V_{растворенное} \; (\rm{мл})}}{\rm{V_{растворенное} \; (\rm{ мл}) \; + \; V_{растворитель} \; (\rm{мл})}} \) × \({100}\)
Хотя эти два уравнения эквивалентны друг другу, первое уравнение должно быть применяется для определения объемного процента раствора, если числовая величина связана со словом «решение» в заданной задаче. Напротив, второе уравнение следует использовать, если указано количество растворителя , присутствующего в растворе.
Напротив, второе уравнение следует использовать, если указано количество растворителя , присутствующего в растворе.
Расчет объемных процентов
Все объемы, включенные в приведенные выше уравнения, должны быть выражены в миллилитрах, а химическая формула каждого компонента должна быть записана как вторичная единица измерения связанного с ним числового количества. Поэтому, если количество растворенного вещества, растворителя или раствора указано в альтернативной единице, его значение необходимо будет преобразовать в миллилитры перед включением в уравнение объемных процентов. Чтобы упростить второе уравнение, порядок операций диктует, что сначала происходит добавление объемов растворенного вещества и растворителя. Полученное математическое утверждение идентично первому уравнению, представленному выше.
При последующем умножении и делении единица измерения объема отменяется, так как в числителе и знаменателе упрощаемой пропорции присутствует «мл». Поскольку в результате этой отмены все единицы, основанные на объеме, исключаются, расчетный ответ выражается в процентах.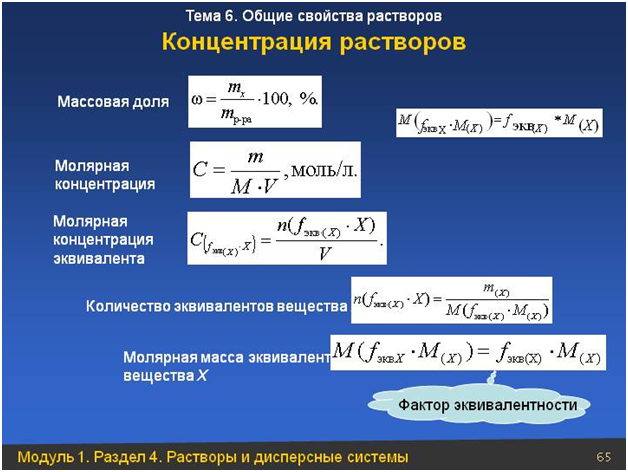 Однако, как указано выше, количество растворенного вещества, которое присутствует в данном растворе, может быть выражено с помощью трех уникальных процентных концентраций. Чтобы отличить объемный процент, который рассчитывается путем упрощения объем к объему соотношение, от других концентраций, основанных на процентах, единицей, в которой сообщается объемная процентная концентрация, является «% об./об.», а химическая формула растворенного вещества записывается как вторичная единица на этой расчетное количество.
Однако, как указано выше, количество растворенного вещества, которое присутствует в данном растворе, может быть выражено с помощью трех уникальных процентных концентраций. Чтобы отличить объемный процент, который рассчитывается путем упрощения объем к объему соотношение, от других концентраций, основанных на процентах, единицей, в которой сообщается объемная процентная концентрация, является «% об./об.», а химическая формула растворенного вещества записывается как вторичная единица на этой расчетное количество.
Наконец, поскольку объемные проценты не определяются как точные количества, их значения должны указываться с использованием правильного количества значащих цифр. Однако «100» — это точное число, поэтому оно не влияет на значимость окончательной зарегистрированной концентрации.
Упражнение \(\PageIndex{1}\)
Рассчитайте объемный процент раствора, приготовленного путем смешивания 519,2 миллилитров гелия и 168,4 миллилитров молекулярного хлора.
- Ответить
- Чтобы рассчитать объемный процент раствора, каждое вещество, указанное в задаче, должно быть сначала классифицировано как растворенное вещество или растворитель.
 Поскольку в данной формулировке нет ни индикаторного слова «в», ни предела растворимости, относительные количества гелия, He и молекулярного хлора, Cl 2 , необходимо сравнить , чтобы определить, какое химическое вещество является растворителем и какое вещество является растворенным в этом растворе. Гелий, He, является растворителем в этом растворе, так как это химическое вещество присутствует в наибольшем количестве, 519,2 миллилитров, а молекулярный хлор, Cl 2 , является растворенным веществом, так как он присутствует в меньшем количестве, 168,4. миллилитров. В качестве альтернативы, поскольку раствор может содержать только один растворитель, после идентификации гелия, He, в качестве растворителя в этом растворе, молекулярного хлора, Cl 2 , можно классифицировать как растворенное вещество «по умолчанию».
Поскольку в данной формулировке нет ни индикаторного слова «в», ни предела растворимости, относительные количества гелия, He и молекулярного хлора, Cl 2 , необходимо сравнить , чтобы определить, какое химическое вещество является растворителем и какое вещество является растворенным в этом растворе. Гелий, He, является растворителем в этом растворе, так как это химическое вещество присутствует в наибольшем количестве, 519,2 миллилитров, а молекулярный хлор, Cl 2 , является растворенным веществом, так как он присутствует в меньшем количестве, 168,4. миллилитров. В качестве альтернативы, поскольку раствор может содержать только один растворитель, после идентификации гелия, He, в качестве растворителя в этом растворе, молекулярного хлора, Cl 2 , можно классифицировать как растворенное вещество «по умолчанию».Поскольку в данной задаче указано количество гелия He, второе уравнение, представленное выше, следует применить для определения объемного процента этого раствора.
 Прежде чем можно будет применить это уравнение, необходимо подтвердить достоверность единиц, связанных с заданными числовыми значениями. Как указано выше, все объемы, включенные в приведенные выше уравнения, должны быть указаны в миллилитрах. Таким образом, данные количества выражены в соответствующих единицах и могут быть непосредственно включены в указанное уравнение, как показано ниже. Чтобы упростить это уравнение, порядок операций требует, чтобы сначала добавлялись объемы растворенного вещества и растворителя. При последующем умножении и делении единица объема отменяется, поскольку в упрощаемой пропорции в числителе и знаменателе присутствует «мл». Поскольку в результате этой отмены все единицы, основанные на объеме, исключаются, единицей, в которой сообщается результирующая объемная процентная концентрация, является «% v/v Cl 9».0065 2 «, чтобы отличить объемный процент, который рассчитывается путем упрощения отношения объема к объему , от других концентраций, основанных на процентах.
Прежде чем можно будет применить это уравнение, необходимо подтвердить достоверность единиц, связанных с заданными числовыми значениями. Как указано выше, все объемы, включенные в приведенные выше уравнения, должны быть указаны в миллилитрах. Таким образом, данные количества выражены в соответствующих единицах и могут быть непосредственно включены в указанное уравнение, как показано ниже. Чтобы упростить это уравнение, порядок операций требует, чтобы сначала добавлялись объемы растворенного вещества и растворителя. При последующем умножении и делении единица объема отменяется, поскольку в упрощаемой пропорции в числителе и знаменателе присутствует «мл». Поскольку в результате этой отмены все единицы, основанные на объеме, исключаются, единицей, в которой сообщается результирующая объемная процентная концентрация, является «% v/v Cl 9».0065 2 «, чтобы отличить объемный процент, который рассчитывается путем упрощения отношения объема к объему , от других концентраций, основанных на процентах. Химическая формула растворенного вещества записывается как вторичная единица на рассчитанное количество, и применение правильного количества значащих цифр к этому значению приводит к окончательному ответу, показанному ниже.
Химическая формула растворенного вещества записывается как вторичная единица на рассчитанное количество, и применение правильного количества значащих цифр к этому значению приводит к окончательному ответу, показанному ниже.\(\text{Объемный процент}\) = \( \dfrac{168,4 \; \rm{мл} \; \rm{Cl_2}}{168,4 \; \rm{мл} \; \rm{Cl_2} \; + \; 519.2 \; \rm{мл} \; \rm{He}}\) × \({100}\)
\(\text{Объемный процент}\) = \( \dfrac{168,4 \; \cancel{\rm{мл}} \; \rm{Cl_2}}{687,6 \; \cancel{\rm{мл}} \; \rm{решение}}\) × \({100}\)
\(\text{Объемный процент}\) = \({24,49098… \%\ \rm{v/v} \; \rm{Cl_2}} ≈ {24,49 \%\ \rm{v/v} \;\rm{Cl_2}}\)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
Концентрация раствора
Водный раствор состоит как минимум из двух
компоненты, растворитель (вода) и растворенное вещество (вещество, растворенное в
вода). Обычно нужно отслеживать количество растворенного вещества.
в растворе. Мы называем это концентрациями. Можно было бы сделать, сохраняя
отслеживать концентрацию путем определения массы каждого компонента, но
Обычно жидкости легче измерять по объему, а не по массе. Сделать это
обычно используется мера, называемая молярностью. Молярность (M) определяется как число
количество молей растворенного вещества (n), деленное на объем (V) раствора в литрах.
Важно отметить, что молярность
определяется как моль растворенного вещества на литр раствора, а не моль растворенного вещества на
литр растворителя. Это потому, что когда вы добавляете вещество, например, соль,
Это потому, что когда вы добавляете вещество, например, соль,
к некоторому объему воды объем полученного раствора будет другим
чем исходный объем каким-то непредсказуемым образом. Чтобы обойти эту проблему
химики обычно готовят растворы в мерных колбах. Это
колбы, имеющие длинное горлышко с вытравленной линией, указывающей объем.
Сначала в колбу добавляют растворенное вещество (возможно, соль), а затем воду.
добавляют до тех пор, пока раствор не достигнет отметки. Колбы имеют очень хорошую калибровку
поэтому объемы обычно известны как минимум с четырьмя значащими цифрами.
Пример №1:
Расчет молярности
Уравнение для расчета молярности по
моли и объем очень прост. Просто разделите моли растворенного вещества на объем
решение.
Молярность |
Какова молярность (с правильными цифрами
значительных
цифры) 0,40 моль NaCl растворить в 0,250 л?
Ответ
Пример #2 :
Приготовление разбавлений
Раствор можно сделать менее концентрированным путем разбавления растворителем.
Если раствор разбавить от V 1 до V 2 , молярность
этого решения изменяется согласно уравнению:
M 1 Моль растворенного вещества |
Единицы измерения объема должны быть одинаковыми для обоих объемов.
в этом уравнении. В общем, М 1 обычно называют начальным
молярность раствора. V 1 относится к объему, который
перенесено. M 2 относится к конечной концентрации раствора
и V 2 — конечный общий объем раствора.
Помните, что номер
молей растворенного вещества не меняется при добавлении к раствору большего количества растворителя.
Однако концентрация изменяется при добавлении количества растворителя.

 Поскольку в данной формулировке нет ни индикаторного слова «в», ни предела растворимости, относительные количества гелия, He и молекулярного хлора, Cl 2 , необходимо сравнить , чтобы определить, какое химическое вещество является растворителем и какое вещество является растворенным в этом растворе. Гелий, He, является растворителем в этом растворе, так как это химическое вещество присутствует в наибольшем количестве, 519,2 миллилитров, а молекулярный хлор, Cl 2 , является растворенным веществом, так как он присутствует в меньшем количестве, 168,4. миллилитров. В качестве альтернативы, поскольку раствор может содержать только один растворитель, после идентификации гелия, He, в качестве растворителя в этом растворе, молекулярного хлора, Cl 2 , можно классифицировать как растворенное вещество «по умолчанию».
Поскольку в данной формулировке нет ни индикаторного слова «в», ни предела растворимости, относительные количества гелия, He и молекулярного хлора, Cl 2 , необходимо сравнить , чтобы определить, какое химическое вещество является растворителем и какое вещество является растворенным в этом растворе. Гелий, He, является растворителем в этом растворе, так как это химическое вещество присутствует в наибольшем количестве, 519,2 миллилитров, а молекулярный хлор, Cl 2 , является растворенным веществом, так как он присутствует в меньшем количестве, 168,4. миллилитров. В качестве альтернативы, поскольку раствор может содержать только один растворитель, после идентификации гелия, He, в качестве растворителя в этом растворе, молекулярного хлора, Cl 2 , можно классифицировать как растворенное вещество «по умолчанию». Прежде чем можно будет применить это уравнение, необходимо подтвердить достоверность единиц, связанных с заданными числовыми значениями. Как указано выше, все объемы, включенные в приведенные выше уравнения, должны быть указаны в миллилитрах. Таким образом, данные количества выражены в соответствующих единицах и могут быть непосредственно включены в указанное уравнение, как показано ниже. Чтобы упростить это уравнение, порядок операций требует, чтобы сначала добавлялись объемы растворенного вещества и растворителя. При последующем умножении и делении единица объема отменяется, поскольку в упрощаемой пропорции в числителе и знаменателе присутствует «мл». Поскольку в результате этой отмены все единицы, основанные на объеме, исключаются, единицей, в которой сообщается результирующая объемная процентная концентрация, является «% v/v Cl 9».0065 2 «, чтобы отличить объемный процент, который рассчитывается путем упрощения отношения объема к объему , от других концентраций, основанных на процентах.
Прежде чем можно будет применить это уравнение, необходимо подтвердить достоверность единиц, связанных с заданными числовыми значениями. Как указано выше, все объемы, включенные в приведенные выше уравнения, должны быть указаны в миллилитрах. Таким образом, данные количества выражены в соответствующих единицах и могут быть непосредственно включены в указанное уравнение, как показано ниже. Чтобы упростить это уравнение, порядок операций требует, чтобы сначала добавлялись объемы растворенного вещества и растворителя. При последующем умножении и делении единица объема отменяется, поскольку в упрощаемой пропорции в числителе и знаменателе присутствует «мл». Поскольку в результате этой отмены все единицы, основанные на объеме, исключаются, единицей, в которой сообщается результирующая объемная процентная концентрация, является «% v/v Cl 9».0065 2 «, чтобы отличить объемный процент, который рассчитывается путем упрощения отношения объема к объему , от других концентраций, основанных на процентах. Химическая формула растворенного вещества записывается как вторичная единица на рассчитанное количество, и применение правильного количества значащих цифр к этому значению приводит к окончательному ответу, показанному ниже.
Химическая формула растворенного вещества записывается как вторичная единица на рассчитанное количество, и применение правильного количества значащих цифр к этому значению приводит к окончательному ответу, показанному ниже.