Содержание
Какой объем раствора серной кислоты нужен?? § 17-18, задача 2. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/класс
Какой объем раствора серной кислоты нужен?? § 17-18, задача 2. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. – Рамблер/класс
Интересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
И вот эту задачу еще не могу сам решить ->> Какой объем 20%-ного раствора серной кислоты (плотность 1,14 г/мл) необходим для нейтрализации 100 мл 6%-ного раствора карбоната натрия (плотность 1,06 г/мл)?
Лучший ответ
Привет, там несложно
Na2CO3+H2SO4=> H2CO3+ Na2SO4
V (Na2CO3) = 6мл
m (Na2CO3) = 6*1,06 = 6. 36г
36г
кол. вещ-ва (Na2CO3) = m/М = 6,36/106 = 0,06моль
кол. вещ-ва (H2SO4) = кол. вещ-ва (Na2CO3) = 0,06моль
m (H2SO4) = 0,06*98 = 5,88г
V (H2SO4) = 5,88/1,14 = 5,16мл
20% = 5,16мл
100% = х
х = 25,8мл
Ответ: 25,8 мл 20%-ного раствора серной кислоты
еще ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г. Е.
Е.
Здравствуйте.
(Подробнее…)
Химия
Какой был проходной балл в вузы в 2017 году?
Какой был средний балл ЕГЭ поступивших в российские вузы на бюджет в этом году? (Подробнее…)
Поступление11 классЕГЭНовости
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И. «3» ) надо взять, чтобы получить 250 см3 2 М раствора? — вопрос №4751560 — Учеба и наука
«3» ) надо взять, чтобы получить 250 см3 2 М раствора? — вопрос №4751560 — Учеба и наука
Лучший ответ по мнению автора
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
реагирует ли уксусная кислота с гидроксидом меди (2)? Если реагирует, то какие получаются продукты реакции? Объясните пожалуйста.
Решено
Задача. Вычислите массу смеси, которая состоит из 4,8 л кислорода и 9,8 л озона (н. у.).
Напишите уравнения реакций получения кислорода, соответствующих данным схемам: а) Na2O2 → O2 б)KNO3 → O2 в) PbO2 → O2 г) h3O2 → O2 д) KClO3 → O2 е) KClO4 → O2 ж) HgO → O2 з) KMnO4 → O2
Обчисліть масу аніліну, що можна добути з нітробензену масою 36,9 г
Решено
Задание 4 (10 баллов).
Почему сера по отношению к фосфору является окислителем, а по отношению к хлору – восстановителем?
Задание 5 (25
Пользуйтесь нашим приложением
7.14: Концентрации: Объемные проценты — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 222384
Цели обучения
- Рассчитайте объемный процент раствора.

Как указывалось ранее, химики определили несколько типов концентраций, в каждом из которых используется отдельная химически приемлемая единица или комбинация единиц для обозначения количества растворенного вещества, растворенного в заданном количестве растворителя. В следующих параграфах будут представлены и применены уравнения, которые используются для расчета объемного процента, который является вторым из трех процентных концентраций, которые будут обсуждаться в этой главе.
Уравнения объемного процента и слова-индикаторы
объемных процента раствора определяется как отношение объема растворенного вещества, присутствующего в растворе, к объему раствора в целом. Кроме того, поскольку этот тип концентрации, который обычно рассчитывается для растворов в жидкой и газовой фазах, выражается в процентах, эту пропорцию необходимо умножить на 100, как показано ниже.
\(\text{Объемный процент}\) = \( \dfrac{ \rm{V_{раствор} \; (\rm{мл})}}{\rm{V_{раствор} \; (\rm{ мл})}} \) × \({100}\)
Поскольку раствор состоит как из растворенного вещества, так и из растворителя, объем раствора в целом равен сумме объемов растворенного вещества и содержащегося в нем растворителя. Следовательно, следующее уравнение также можно использовать для расчета объемного процента раствора.
Следовательно, следующее уравнение также можно использовать для расчета объемного процента раствора.
\(\text{Объемный процент}\) = \( \dfrac{ \rm{V_{растворенное} \; (\rm{мл})}}{\rm{V_{растворенное} \; (\rm{ мл}) \; + \; V_{растворитель} \; (\rm{мл})}} \) × \({100}\)
Хотя эти два уравнения эквивалентны друг другу, первое уравнение должно быть применяется для определения объемного процента раствора, если числовая величина связана со словом «решение» в заданной задаче. Напротив, второе уравнение следует использовать, если указано количество растворителя , присутствующего в растворе.
Расчет объемных процентов
Все объемы, включенные в приведенные выше уравнения, должны быть выражены в миллилитрах, а химическая формула каждого компонента должна быть записана как вторичная единица измерения связанного с ним числового количества. Следовательно, если количество растворенного вещества, растворителя или раствора указывается в альтернативных единицах измерения, его значение необходимо преобразовать в миллилитры перед включением в уравнение объемных процентов. Чтобы упростить второе уравнение, порядок операций диктует, что сначала происходит добавление объемов растворенного вещества и растворителя. Полученное математическое утверждение идентично первому уравнению, представленному выше.
Чтобы упростить второе уравнение, порядок операций диктует, что сначала происходит добавление объемов растворенного вещества и растворителя. Полученное математическое утверждение идентично первому уравнению, представленному выше.
При последующем умножении и делении единица измерения объема отменяется, так как в числителе и знаменателе упрощаемой пропорции присутствует «мл». Поскольку в результате этой отмены все единицы, основанные на объеме, исключаются, расчетный ответ выражается в процентах. Однако, как указано выше, количество растворенного вещества, которое присутствует в данном растворе, может быть выражено с помощью трех уникальных процентных концентраций. Чтобы отличить объемный процент, который рассчитывается путем упрощения объем к объему соотношение, от других концентраций, основанных на процентах, единицей, в которой сообщается объемная процентная концентрация, является «% об./об.», а химическая формула растворенного вещества записывается как вторичная единица на этой расчетное количество.
Наконец, поскольку объемные проценты не определяются как точные количества, их значения должны указываться с использованием правильного количества значащих цифр. Однако «100» — это точное число, поэтому оно не влияет на значимость окончательной зарегистрированной концентрации.
Упражнение \(\PageIndex{1}\)
Рассчитайте объемный процент раствора, приготовленного путем смешивания 519,2 миллилитров гелия и 168,4 миллилитров молекулярного хлора.
- Ответить
- Чтобы рассчитать объемный процент раствора, каждое вещество, на которое есть ссылка в задаче, должно быть сначала классифицировано как растворенное вещество или растворитель. Поскольку в данной формулировке нет ни индикаторного слова «в», ни предела растворимости, относительные количества гелия, He и молекулярного хлора, Cl 2 , необходимо сравнить , чтобы определить, какое химическое вещество является растворителем и какое вещество является растворенным в этом растворе.
 Гелий, He, является растворителем в этом растворе, так как это химическое вещество присутствует в наибольшем количестве, 519,2 миллилитров, а молекулярный хлор, Cl 2 , является растворенным веществом, так как он присутствует в меньшем количестве, 168,4. миллилитров. В качестве альтернативы, поскольку раствор может содержать только один растворитель, после идентификации гелия, He, в качестве растворителя в этом растворе, молекулярного хлора, Cl 2 , можно классифицировать как растворенное вещество «по умолчанию».
Гелий, He, является растворителем в этом растворе, так как это химическое вещество присутствует в наибольшем количестве, 519,2 миллилитров, а молекулярный хлор, Cl 2 , является растворенным веществом, так как он присутствует в меньшем количестве, 168,4. миллилитров. В качестве альтернативы, поскольку раствор может содержать только один растворитель, после идентификации гелия, He, в качестве растворителя в этом растворе, молекулярного хлора, Cl 2 , можно классифицировать как растворенное вещество «по умолчанию».Поскольку в данной задаче указано количество гелия He, второе уравнение, представленное выше, следует применить для определения объемного процента этого раствора. Прежде чем можно будет применить это уравнение, необходимо подтвердить достоверность единиц, связанных с заданными числовыми значениями. Как указано выше, все объемы, включенные в приведенные выше уравнения, должны быть указаны в миллилитрах. Таким образом, данные количества выражены в соответствующих единицах и могут быть непосредственно включены в указанное уравнение, как показано ниже.
 Чтобы упростить это уравнение, порядок операций требует, чтобы сначала добавлялись объемы растворенного вещества и растворителя. При последующем умножении и делении единица объема отменяется, поскольку в упрощаемой пропорции в числителе и знаменателе присутствует «мл». Поскольку в результате этой отмены все единицы, основанные на объеме, исключаются, единицей, в которой сообщается результирующая объемная процентная концентрация, является «% v/v Cl 9».0065 2 , чтобы отличить объемный процент, который рассчитывается путем упрощения отношения объема к объему , от других концентраций, основанных на процентах. Химическая формула растворенного вещества записывается как вторичная единица на рассчитанное количество, и применение правильного количества значащих цифр к этому значению приводит к окончательному ответу, показанному ниже.
Чтобы упростить это уравнение, порядок операций требует, чтобы сначала добавлялись объемы растворенного вещества и растворителя. При последующем умножении и делении единица объема отменяется, поскольку в упрощаемой пропорции в числителе и знаменателе присутствует «мл». Поскольку в результате этой отмены все единицы, основанные на объеме, исключаются, единицей, в которой сообщается результирующая объемная процентная концентрация, является «% v/v Cl 9».0065 2 , чтобы отличить объемный процент, который рассчитывается путем упрощения отношения объема к объему , от других концентраций, основанных на процентах. Химическая формула растворенного вещества записывается как вторичная единица на рассчитанное количество, и применение правильного количества значащих цифр к этому значению приводит к окончательному ответу, показанному ниже.\(\text{Объемный процент}\) = \( \dfrac{168,4 \; \rm{мл} \; \rm{Cl_2}}{168,4 \; \rm{мл} \; \rm{Cl_2} \; + \; 519.2 \; \rm{мл} \; \rm{He}}\) × \({100}\)
\(\text{Объемный процент}\) = \( \dfrac{168,4 \; \cancel{\rm{мл}} \; \rm{Cl_2}}{687,6 \; \cancel{\rm{мл}} \; \rm{решение}}\) × \({100}\)
\(\text{Объемный процент}\) = \({24,49098.
 .. \%\ \rm{v/v} \; \rm{Cl_2}} ≈ {24,49 \%\ \rm{v/v} \;\rm{Cl_2}}\)
.. \%\ \rm{v/v} \; \rm{Cl_2}} ≈ {24,49 \%\ \rm{v/v} \;\rm{Cl_2}}\)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
Концентрация раствора в процентах по объему (видео)
Стенограмма
Привет, и добро пожаловать в это видео об объемных процентах — концентрация растворенного вещества в растворе , рассчитанная в объемных процентах!
Объемный процент, представленный как \(\frac{v}{v \text{%}}\), обычно используется для представления концентрации бинарных смесей жидкостей, поскольку жидкости часто измеряются в объеме.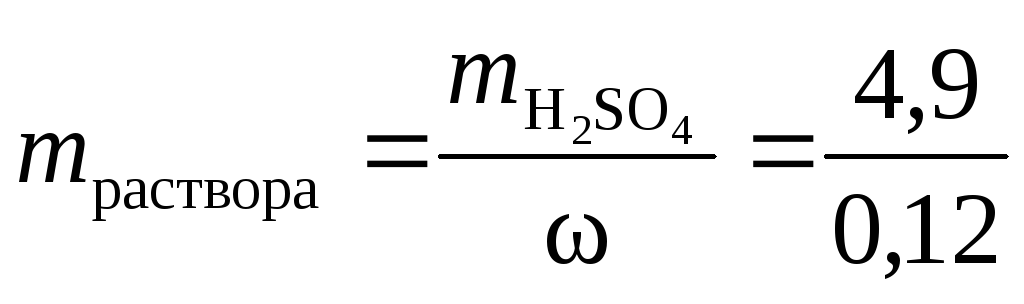 Например, когда вы покупаете в магазине изопропанол (медицинский спирт), вы заметите, что там написано 70% (\(\frac{v}{v}\)), что означает по объему. Это говорит о том, что раствор содержит 70% изопропанола.
Например, когда вы покупаете в магазине изопропанол (медицинский спирт), вы заметите, что там написано 70% (\(\frac{v}{v}\)), что означает по объему. Это говорит о том, что раствор содержит 70% изопропанола.
Уравнение для объемных процентов довольно простое:
\(\frac{v}{v\%} = \frac{\text{объем растворенного вещества}}{\text{объем раствора}} \times 100 \)
Итак, возвращаясь к нашему спирту, 70% (\(\frac{v}{v}\)) означает, что на каждые 100 мл раствора приходится 70 мл растворенного вещества, изопропанола.
\(70\% = \frac{\text{объем растворенного вещества}}{100\text{мл}} \умножить на 100\)
Объем растворенного вещества = 70 мл
Давайте рассмотрим бутылку вина, указанную как 12% ABV (алкоголь по объему, что является другим способом сказать объемный процент).
\(12\% = \frac{\text{объем растворенного вещества}}{750 \text{мл}} \умножить на 100\)
Бутылка 750 мл, значит, вино содержит 90 мл этанола.
В этих двух примерах мы показали, что, зная общий объем раствора и объемный процент, вычислить объем растворенного вещества довольно просто.
Однако, если вы планируете приготовить раствор с определенным объемным процентом, вам следует помнить о небольшом предостережении при работе в лаборатории. Рассмотрим другой пример.
Допустим, вы хотите приготовить 70% \(\frac{v}{v%}\) раствор этанола в воде. Вы готовите стаканы с 70 мл этанола и 30 мл воды. Смешивая их вместе, вы уверены, что это даст вам желаемую смесь 70% \(\frac{v}{v%}\).
Но когда вы нальете 70 мл этанола и 30 мл воды в свой градуированный цилиндр, вы обнаружите, что вам не хватило! В вашем градуированном цилиндре всего 96 мл раствора. Как это возможно?
Когда вы смешали две жидкости, молекулы этанола и воды начали взаимодействовать друг с другом, упаковываясь друг с другом иначе, чем в чистом этаноле или чистой воде. Это приводит к новой плотности раствора и, следовательно, к объему, который не равен сумме двух исходных объемов. Другими словами, объем раствора, знаменатель нашего уравнения объемных процентов, не равен объему растворенного вещества плюс объем растворителя. В случае воды и этанола их смесь имеет меньший объем, чем сумма чистых жидкостей.
Другими словами, объем раствора, знаменатель нашего уравнения объемных процентов, не равен объему растворенного вещества плюс объем растворителя. В случае воды и этанола их смесь имеет меньший объем, чем сумма чистых жидкостей.
Так как же на самом деле приготовить 70% \(\frac{v}{v%}\) раствор этанола в воде? Вместо того, чтобы добавлять предварительно измеренные жидкости вместе, вы должны заполнить мерный цилиндр 70 мл этанола, а затем долить до 100 мл воды. Таким образом, вы достигли общего объема 100 мл, 70 из которых составляют этанол, но вы добавили немного больше воды, чем ожидали изначально.
Разница между объемом растворенного вещества плюс объемом растворителя и объемом раствора, как правило, довольно мала, поэтому вам часто будет предложено предположить, что они одинаковы.
Например, вы можете получить такой вопрос, как объемный процент этанола в смеси 40 мл этанола и 80 мл воды (предположим, что объем раствора составляет 120 мл).
\(\frac{v}{v\%} = \frac{40\text{мл}}{120\text{мл}} × 100=33,3\%\text{этанол}\frac{v} {v}\)
Теперь вы должны понимать, о чем вас спрашивают, и легко выполнять вычисления.

 05.22
05.22
 Гелий, He, является растворителем в этом растворе, так как это химическое вещество присутствует в наибольшем количестве, 519,2 миллилитров, а молекулярный хлор, Cl 2 , является растворенным веществом, так как он присутствует в меньшем количестве, 168,4. миллилитров. В качестве альтернативы, поскольку раствор может содержать только один растворитель, после идентификации гелия, He, в качестве растворителя в этом растворе, молекулярного хлора, Cl 2 , можно классифицировать как растворенное вещество «по умолчанию».
Гелий, He, является растворителем в этом растворе, так как это химическое вещество присутствует в наибольшем количестве, 519,2 миллилитров, а молекулярный хлор, Cl 2 , является растворенным веществом, так как он присутствует в меньшем количестве, 168,4. миллилитров. В качестве альтернативы, поскольку раствор может содержать только один растворитель, после идентификации гелия, He, в качестве растворителя в этом растворе, молекулярного хлора, Cl 2 , можно классифицировать как растворенное вещество «по умолчанию». Чтобы упростить это уравнение, порядок операций требует, чтобы сначала добавлялись объемы растворенного вещества и растворителя. При последующем умножении и делении единица объема отменяется, поскольку в упрощаемой пропорции в числителе и знаменателе присутствует «мл». Поскольку в результате этой отмены все единицы, основанные на объеме, исключаются, единицей, в которой сообщается результирующая объемная процентная концентрация, является «% v/v Cl 9».0065 2 , чтобы отличить объемный процент, который рассчитывается путем упрощения отношения объема к объему , от других концентраций, основанных на процентах. Химическая формула растворенного вещества записывается как вторичная единица на рассчитанное количество, и применение правильного количества значащих цифр к этому значению приводит к окончательному ответу, показанному ниже.
Чтобы упростить это уравнение, порядок операций требует, чтобы сначала добавлялись объемы растворенного вещества и растворителя. При последующем умножении и делении единица объема отменяется, поскольку в упрощаемой пропорции в числителе и знаменателе присутствует «мл». Поскольку в результате этой отмены все единицы, основанные на объеме, исключаются, единицей, в которой сообщается результирующая объемная процентная концентрация, является «% v/v Cl 9».0065 2 , чтобы отличить объемный процент, который рассчитывается путем упрощения отношения объема к объему , от других концентраций, основанных на процентах. Химическая формула растворенного вещества записывается как вторичная единица на рассчитанное количество, и применение правильного количества значащих цифр к этому значению приводит к окончательному ответу, показанному ниже. .. \%\ \rm{v/v} \; \rm{Cl_2}} ≈ {24,49 \%\ \rm{v/v} \;\rm{Cl_2}}\)
.. \%\ \rm{v/v} \; \rm{Cl_2}} ≈ {24,49 \%\ \rm{v/v} \;\rm{Cl_2}}\)